اختبار XTT هو اختبار يستخدم لقياس النشاط الأيضي الخلوي كمؤشر على السمية الخلوية وقابليتها للحياة والانتشار.
في هذه المقالة سنشرح بالتفصيل المعمل الافتراضي ل اختبار XTT للكشف عن حيوية الخلايا الذي توفره معامل براكسيلابس ، لفهم أهمية التجربة والأساس العلمي والبروتوكول والإجراءات والنتائج.
قبل الحديث عن تجربة اختبار XTT دعونا نوضح اولا ما هي السمية الخلوية
السمية الخلوية هي السمية التي يسببها عمل عامل العلاج الكيميائي على الخلايا الحية. تعتبر اختبارات السمية الخلوية مهمة جدا على وجه التحديد في الجسيمات النانوية لأنها تساعد في تحديد الاستخدام الطبي الحيوي لهذه الجزيئات.
هناك العديد من الطرق المستخدمة للكشف عن السمية الخلوية وتحديد صلاحية الخلية مثل:
الصبغات التي تستخدم للتمييز بين الخلايا المختلفة اعتمادا على الألوان (بناء على نسبة امتصاص اللون لكل من الخلايا الحية والميتة). على سبيل المثال: Alamar Blue و trypan Blue.
اختبار MTT
اختبار XTT
فحص WST
فحوصات السمية الخلوية شائعة وتستخدمها صناعة الأدوية للعديد من الأغراض الحيوية، فمثلا:
في تقنية النانو ، يمكن استخدامه للبحث عن المواد النانوية السامة للخلايا واكتشاف امكانية انتاج دواء نانوي يستهدف الخلايا السرطانية سريعة الانقسام أو يمكنهم الوصول للتأثيرات السامة للخلايا غير المرغوب فيها قبل الاستثمار في تطويرها كطب نانوي. ويمكن أيضا مراقبة السمية الخلوية عن طريق قياس إمكانات تقليل الخلايا باستخدام تفاعل لوني.
مبدأ اختبار XTT
يعتمد مبدأ اختبار XTT على حقيقة أن الميتوكوندريا الموجودة في السيتوبلازم الخلوي تحتوي على العديد من الإنزيمات. من بين هؤلاء ، نظام إنزيم محدد يسمى نظام “اختزال سكسينات-تيترازوليوم” الذي ينتمي إلى السلسلة التنفسية للميتوكوندريا وينشط فقط في الخلايا القابلة للحياة.
تهدف تجربة فحص XTT إلى اختبار نشاط النظام الأنزيمي (صلاحية الخلايا المستزرعة) وتقيس هذا النشاط في الخلايا المعالجة بالجسيمات النانوية مقارنة بالخلايا الضابطة غير المعالجة.
بروتوكول اختبار XTT
يهدف بروتوكول اختبار XTT للكشف عن حيوية الخلايا إلى اختبار صلاحية الخلايا المستزرعة بعد التعرض لجسيمات نانوية مختلفة بتركيز هندسي.
في وجود نظام اختزال السكسينات -تيترازوليزم في الخلايا النشطة الميتوكوندريا ، يحدث انشقاق ملح التترازوليوم إلى الفورمازان.
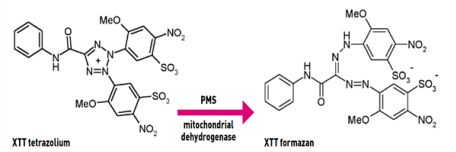
يتم تحويل ملح التترازوليوم الأصفر (XTT) أو شقه إلى فورمازان صبغة برتقالية قابلة للذوبان ويمكن قياسه عن طريق الامتصاص عند 490 (أو 450) نانومتر في قارئ الصفيحة الدقيقة(microplate reader).
المعمل الافتراضي ل اختبار XTT للكشف عن حيوية الخلايا من براكسيلابس
نحن نقدم محاكاة ثلاثيىة الابعاد لتجربة (التحليل اللوني في المختبر للكشف عن حيوية الخلايا بواسطة اختبار XTT) لطلاب الدراسات العليا.
بنهاية المحاكاة، سيكون الطلاب قادرين على القيام بما يلي وفهمه:
- إضافة كاشف XTT إلى الخلايا وقراءة النتائج باستخدام قارئ الصفائح الدقيقة.
- قراءة نتائج اختبار XTT وحساب النسبة المئوية لصلاحية الخلية بعد التعرض لجرعات مختلفة من المواد الكيميائية المختبرة.
- حساب تركيز المواد الكيميائية المختبرة ثم القيام بتحضيرها في وسط زراعة الخلية.
- إزالة الوسط القديم وإضافة الوسط الجديد الذي يحتوي على المواد الكيميائية المختبرة في الآبار المناسبة.
- عد الخلايا تحت المجهر والتحقق من التقاء.
- تجريب عملية تخفيف الخلايا إلى عدد محدد مناسب للبذر في لوحة 96 بئر.
الطريقة
التحليل اللوني في المختبر لصلاحية الخلية بواسطة فحص XTT
الأجهزة والكواشف المستخدمة في تجربة اختبارXTT
الاجهزه:
حجرة التدفق الصفحي
الطرد المركزي.
مجهر.
حاضنة ثاني اكسيد الكربون.
غرفة عد الخلايا نيوباور).
الكواشف والمواد المستخدمة:
قوارير زراعة الأنسجة T-25.
ماصات أوتوماتيكية متغيرة (1-10 ، 20-200 ، و 100-1000 ميكرولتر).
96 لوحة بئر.
8-ماصة متعددة القنوات.
ماصات أوتوماتيكية متغيرة (1-10 ، 20-200 ، و 100-1000 ميكرولتر).
مساعدات ماصة.
وسط DMEM مع الفينول الأحمر، وجلوكوز و L- الجلوتامين مرتفع.
وسط DMEM مع جلوكوز و L- الجلوتامين مرتفع ، دون الفينول الأحمر.
بنسلين
الستربتومايسين
التربسين 10x والتربسين 1x.
مصل بقري الجنين (FBS).
محلول ملحي معقم بالفوسفات (PBS).
عوامل اقتران الإلكترون، مثل فينازين ميثوسلفات (PMS).
ملح الصوديوم XTT.
إجراءات وخطوات اختبار XTT
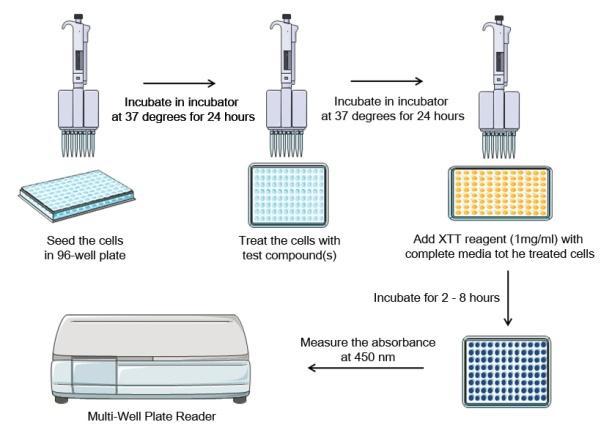
يستغرق إجراء تجربة فحص XTT حوالي 3 أيام: –
اليوم الأول:
- قبل العمل ، قم بتنظيف سطح العمل لحجرة التدفق الصفحي بنسبة 70٪ من الإيثانول.
- تخلص من الاوساط المستخدمة في قارورة زراعة الأنسجة T-25 في حاوية النفايات.
اغسل الخلايا عن طريق سحب 5 مل من محلول الملح المتوازن بدون الكالسيوم والمغنيسيوم إلى جانب الوعاء المقابل لطبقة الخلية المرفقة لتجنب التأثير على طبقة الخلية.
بلطف ، حرك الوعاء ذهابا وإيابا عدة مرات.
ملاحظة: تزيل خطوة الغسيل أي آثار للكالسيوم والمغنيسيوم والمصل التي قد تمنع عمل كاشف فصل التربسين.
- قم بإزالة محلول الغسيل من قارورة الزراعة في حاوية النفايات.
ملاحظة: كرر خطوة الغسيل مرة أخرى.
- جرب قارورة T-25 واحدة بإضافة 1 مل من محلول التربسين / EDTA 1x إلى دورق T-25.
- قبل العمل ، قم بتنظيف سطح العمل لحجرة التدفق الصفحي بنسبة 70٪ من الإيثانول.
- احتضان القارورة في حاضنة ثاني اكسيد الكربون لمدة 5 دقائق.
- . بعد الحضانة ، راقب الخلايا التربسينية تحت المجهر الضوئي المقلوب للتأكد من أن 90٪ من الخلايا قد انفصلت بالفعل عن القارورة.ملاحظة: إذا كانت الخلايا منفصلة بنسبة أقل من 90٪ ، فقم بزيادة وقت الحضانة ببضع دقائق أخرى ، وتحقق من التفكك كل 30 ثانية. أيضا ، اضغط على الوعاء لتسريع انفصال الخلية.
- بعد انفصال الخلية ، أضف 5 مل من وسط الاستزراع الكامل إلى خلايا التربسين لإيقاف التربسين.
- اجمع الخلايا المفككة والمنفصلة بعناية عن طريق سحب الوسط لأعلى ولأسفل عدة مرات على سطح طبقة الخلية.
- اجمع خلايا التربسين من قارورة T-25 مع ماصة وضعها في أنبوب فالكون سعة 15 مل.
- قبل العمل ، قم بتنظيف سطح العمل لحجرة التدفق الصفحي بنسبة 70٪ من الإيثانول.
- ضع أنبوب فالكون على جهاز الطرد المركزي عند 1000 دورة في الدقيقة لمدة 5 دقائق عند 25 درجة مئوية.
- قم بإزالة الاوساط الطافية من أنبوب ابندروف عن طريق سحب العينات.
ملاحظة: احرص على عدمالتاثير على الحبيبات أثناء إزالة المادة الطافية.
- أعد تعليق الخلايا المحببة في أنبوب فالكون بإضافة 1 مل من وسط الاستزراع الكامل عن طريق السحب لأعلى ولأسفل.
- في أنبوب ابندروف جديد ، خذ 10 ميكرولتر من الخلايا المعاد تعليقها و 40 ميكرولتر من صبغة تريبان الزرقاء واخلطها عن طريق السحب ، ثم ضع 10 ميكرولتر من المحلول المختلط في غرفة عد نيوباور.
ملاحظة: تذكر أن تحتضن أنبوب فالكون في حاضنة ثاني اكسيد الكربون أثناء عد الخلايا.
- قبل العمل ، قم بتنظيف سطح العمل لتدفق الهواء الصفحي بنسبة 70٪ من الإيثانول.
- عد الخلايا في المربعات الطرفية 4 تحت مجهر ضوئي مستقيم واحسب متوسط عددها. استخدم الصيغة التالية:
عدد الخلايا / مل = متوسط عدد الخلايا (في 4 مربعات كبيرة) × عامل التخفيف × 10E + 04 (104)
مثال: إذا كانت أعداد المربعات الطرفية الأربعة هي 73 و 75 و 85 و 87 ، فإن متوسطها = (73 + 75 + 85 + 87) / 4 = 320/4 = 80.
إجمالي عدد الخلايا / مل = 80 * 5 * 104 = 400 * 104 (4 ملايين خلية لكل ملليلتر).
- لبذر الخلايا في لوحة 96 بئر ، ماصة 9.9 مل من المستنبت او الوسط الكامل في أنبوب جديد وإضافة 100 ميكرولتر من الخلايا (يحتوي على 400000 خلية) وتخلط بعناية.
- صب الخليط في حوض ماصة. استخدم ماصة ذات 8 قنوات لاقتباس 100 ميكرولتر من الخلايا المعاد تعليقها (4000 خلية) في كل بئر من أعمدة لوحة البئر البالغ عددها 96 ، باستثناء العمود الأول الذي سيتم اعتباره التحكم غير الخلوي (NCC).
ملاحظة: لتجنب التكرار الغير صالح بين الآبار ، تأكد من عدم وجود فقاعات داخل الآبار ، وتحقق من دقة الماصات ، وحجم خلايا الماصة بدقة.
- قبل العمل ، قم بتنظيف سطح العمل لحجرة التدفق الصفحي بنسبة 70٪ من الإيثانول.
- احتضان اللوحة بأكملها في حاضنة ثاني اكسيد الكربون لمدة 24-48 ساعة.
اليوم الثاني:
- قبل العمل ، قم بتنظيف سطح العمل لحجرة التدفق الصفحي بنسبة 70٪ من الإيثانول.
- من محلول مخزون 10 ميكروغرام / ميكرولتر من الجسيمات النانوية لأكسيد التيتانيوم والفضة وأكسيد الحديد (المغنتيت) مواد نانونية (NPs) ، قم بإعداد التركيزات التالية لكل NP وفقا للجدول التالي. خذ مع micropipette الأحجام المطلوبة من محلول المخزون وملء الوسط ومزجها في أنبوب جديد لكل تركيز:
تركيز المواد النانونية حجم المحلول المخزن حجم وسط الاستزراع الكامل 1. 100 µg 50 µl 450 µl 2. 50 µg 25 µl 475 µl 3. 25 µg 12.5 µl 487.5 µl 4. 12.5 µg 6.25 µl 493.75 µl 5. 6.25 µg 3.125 µl 496.875 µl 6. عينة التحكم 50 µl ((ماء مقطر 450 µl 7. عينة التحكم غير الخلوي (NCC). —— 500 µl - أخرج لوحة 96 بئرا من الحاضنة. في حجرة التدفق الصفحي ، قم بشفط الوسط القديم بعناية من آبار الألواح بواسطة ماصة ذات 8 قنوات.
- خد 100 ميكرولتر من كل تركيزات الجسيمات النانوية المحضرة في 4 آبار فقط باستخدام ماصة دقيقة ، وفقا للمخطط التالي:

حيث، (NCC = التحكم غير الخلوي; الآبار 1A إلى 1H) ، (VC = التحكم المتحرك؛ الآبار 2A إلى 2H) ، (T1 = معالجة أكسيد الزنك النانوي ؛ الآبار 3A إلى 5D) ، (T2 = معالجة أكسيد التيتانيوم النانوي ؛ الآبار 5E إلى 7H) ، (T3 = معالجة الفضة النانوية ؛ الآبار 8A إلى 10D) ، و (T4 = معالجة أكسيد الحديد النانوي 4 ؛ الآبار 10E إلى 12H).
- قبل العمل ، قم بتنظيف سطح العمل لحجرة التدفق الصفحيبنسبة 70٪ من الإيثانول.
- احتضان اللوحة المعالجة في الحاضنة لمدة 24-48 ساعة.
- قبل العمل ، قم بتنظيف سطح العمل لحجرة التدفق الصفحي بنسبة 70٪ من الإيثانول.
اليوم الثالث:
- إزالة الزراعات الناتجة من الحاضنة إلى حجرة التدفق الصفحي.
- قبل العمل ، قم بتنظيف سطح العمل لحجرة التدفق الصفحي بنسبة 70٪ من الإيثانول.
- حضر محلول عمل XTT مباشرة قبل الاستخدام عن طريق إضافة وإذابة 5 مجم ملح XTT في 5 مل من وسط الاستزراع الكامل (1 مجم / مل) داخل أنبوب فالكون.
- قم بإعداد محلول عمل XTT بإضافة 10 ميكرولتر من فينازين ميثوسلفات (عامل اقتران الإلكترون) إلى محلول الملح XTT المحضر في الخطوة السابقة.
- أضف 50 ميكرولتر من حل عمل XTT إلى كل بئر من لوحة 96 بئرا باستخدام ماصة متعددة القنوات.
- قبل العمل ، قم بتنظيف سطح العمل لحجرة التدفق الصفحي بنسبة 70٪ من الإيثانول.
- قم بتغطية اللوحة ووضعها داخل قارئ الصفيحة الدقيقة. اقرأ الامتصاص عند 450 نانومتر باستخدام قارئ لوحة متعدد الآبار ، بطول موجي مرجعي يبلغ 690 نانومتر (لتصحيح بصمات الأصابع واللطخات وما إلى ذلك على غطاء اللوحة).
النتائج
يقوم الطالب بإخراج الصفيحة الدقيقة من قارئ الألواح متعدد الآبار. يجب أن تبدو الصفيحة الدقيقة كما يلي:

الحسابات:
من قراءات الامتصاص لمعالجة أكسيد الزنك النانوي ، احسب نسبة حيوية الخلايا وفقا للمعادلة التالية:
متوسط الامتصاص لكل مجموعة من العينات المعالجة
نسبة حيوية الخلايا = —————————————————————————- × 100
متوسط امتصاص عينات التحكم المتحركة (VC)
تذكر أن:
تشير نسب الصلاحية او الحيوية المنخفضة إلى مدى سمية تركيز الجسيمات النانوية المختبرة على الخلايا المختبرة.
تعتبر جرعة 50٪ من نسبة الحيوية بمثابة LC50 للجسيمات النانوية المختبرة على خطوط خلايا معينة.
تشير نسب الحيوية الأعلى بكثير إلى مدى أمان الجسيمات النانوية في المختبر.
إذا كان امتصاص الفراغات مرتفعا ، فقد يعني ذلك أن وسط الاستزراع يحتوي على عامل اختزال وفي هذه الحالة يجب استخدام وسط بديل.
قم بإنشاء حسابك المجاني الآن وجرب محاكاة المختبر الافتراضي التي تأتي مع ميزات مثيرة لجعل التعلم في متناول جميع المتعلمين ولتحقيق المزيد من القيمة!
 براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس
براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس








