تلعب الأحماض والقواعد دورًا حيويًا في عدد كبير جدا من العمليات المختلفة، بدءًا من استخدامها بشكل كبير في المنظفات وحتى التفاعلات البيولوجية داخل أجسامنا. ولكن كيف يمكنك التمييز بين محاليل الحوامض والقواعد؟ وعلى ماذا تعتمد قوة الحامض والقاعدة؟ أو ما الذي يحدد قوة الحمض أو القاعدة؟ والأهم دور المختبرات الافتراضية في فهم كل هذه التساؤلات.
في هذه المقالة، سنجيب على كل هذه التساؤلات وأكثر من خلال تجربة في المختبر الافتراضي قوة الأحماض والقواعد، فمن خلال مراقبة هذه التفاعلات وتحليل البيانات، سنفهم قوة الأحماض والقواعد.
أطلب ديمو مجاني الآن! لتعش تجربة المعامل الإفتراضية
اكتشف عالم الأحماض والقواعد
في البداية دعونا نتذكر مفهوم الحمض والقاعدة وأهم خصائص كلًا منهما
الحمض
هو مادة تنتج أيونات الهيدروجين الموجبة (H+) عندما تذوب في الماء (على الأقل أيون واحد هيدروجين). تعتبر الأحماض مواد مانحة او متبرعة للبروتونات.
أهم خصائص الأحماض
- تتميز الأحماض بطعم حامضي.
- تتفاعل مع القواعد وتشكل الأملاح.
- يمكنها تحفيز التفاعلات الكيميائية.
- تغيير لون ورق عباد الشمس من الأزرق إلى الأحمر.
- موصل تيار كهربائي جيد.
- تتفاعل مع بعض المعادن لفصل الهيدروجين.
- تذوب في الماء.
- عند ملامستها للخلايا الحية تتلفها.
- يتم استخدامها في صناعة الدهانات وبطاريات السيارات وحفظ المواد الغذائية والأسمدة الزراعية وغيرها.
- الأحماض المعدنية عديمة اللون وفي الحالة الصلبة تكون الأحماض العضوية بيضاء.
- أمثلة: الخل (حمض الخليك) / حمض الهيدروكلوريك / حمض الكبريتيك.
القاعدة
هي مادة تعادل الحمض لانتاج ملح وماء. تنقسم القواعد لتشكيل أيونات الهيدروكسيد السالبة (OH- ) عند إذابتها في الماء (تسمى القاعدة التي تمت إضافتها إلى الماء بالمحلول القلوي). القواعد هي مستقبلات البروتونات ولقبول البروتونات يجب أن يكون لها زوج وحيد(زوج غير رابط) من الالكترونات.
أهم خصائص القواعد
- تتميز القواعد بملمس صابوني ويمكن أن تغير بنية البروتين.
- تغيير لون ورق عباد الشمس من الأحمر إلى الأزرق.
- تتفاعل مع الأحماض وتشكل الأملاح.
- موصل تيار كهربائي جيد.
- هي مواد مسببة للتآكل والتي يمكن أن تلحق الضرر بالمواد الأخرى.
- معظم القواعد عديمة اللون.
- القواعد القوية يمكن أن تسبب حروقا شديدة نتيجة لقدرتها على أن تتلف خلايا الجلد.
- بعض القواعد قابلة للذوبان في الماء ولكن البعض الآخر ليس كذلك.
- يشيع استخدامها في صناعة الصابون.
أمثلة: الأمونيا / هيدروكسيد الصوديوم / هيدروكسيد البوتاسيوم
كيف يمكنك التمييز بين محاليل الحوامض والقواعد؟
إذا كنت تتسائل ” كيف اعرف المركب حمضي او قاعدي؟ ” فاليك بعض الطرق الاساسية للكشف والتمييز بين الأحماض والقواعد المختلفة:
- اختبار ورق عباد الشمس
- الأس أو الرقم الهيدروجيني
- المؤشر العالمي
اختبار ورق عباد الشمس
يعتبر اختبار ورق عباد الشمس من أبسط وأسهل الطرق المستخدمة للتمييز بين محاليل الأحماض والقواعد. تمكننا هذه الطريقة من تحديد ما إذا كان المحلول حمضًا أم قاعدة ولكنها لا تستطيع إخبارننا بمدى قوة المحلول.
يتم اجراء الاختبارعن طريق غمس شريط خاص من الورق (ورق عباد الشمس) في المحلول المراد الكشف عنه ومراقبة لون الورقة.
- يتحول لون ورق عباد الشمس إلى اللون الأزرق في حالة المحاليل القاعدية.
- يتحول لون ورق عباد الشمس إلى اللون الأحمر في حالة المحاليل الحمضية.
جرب معمل العلوم الافتراضي من براكسيلابس في أفرع الكيمياء المختلفة حيث يوجد أكثر من 45 تجربة مختلفة وفريدة من نوعها
مقياس الأس الهيدروجيني
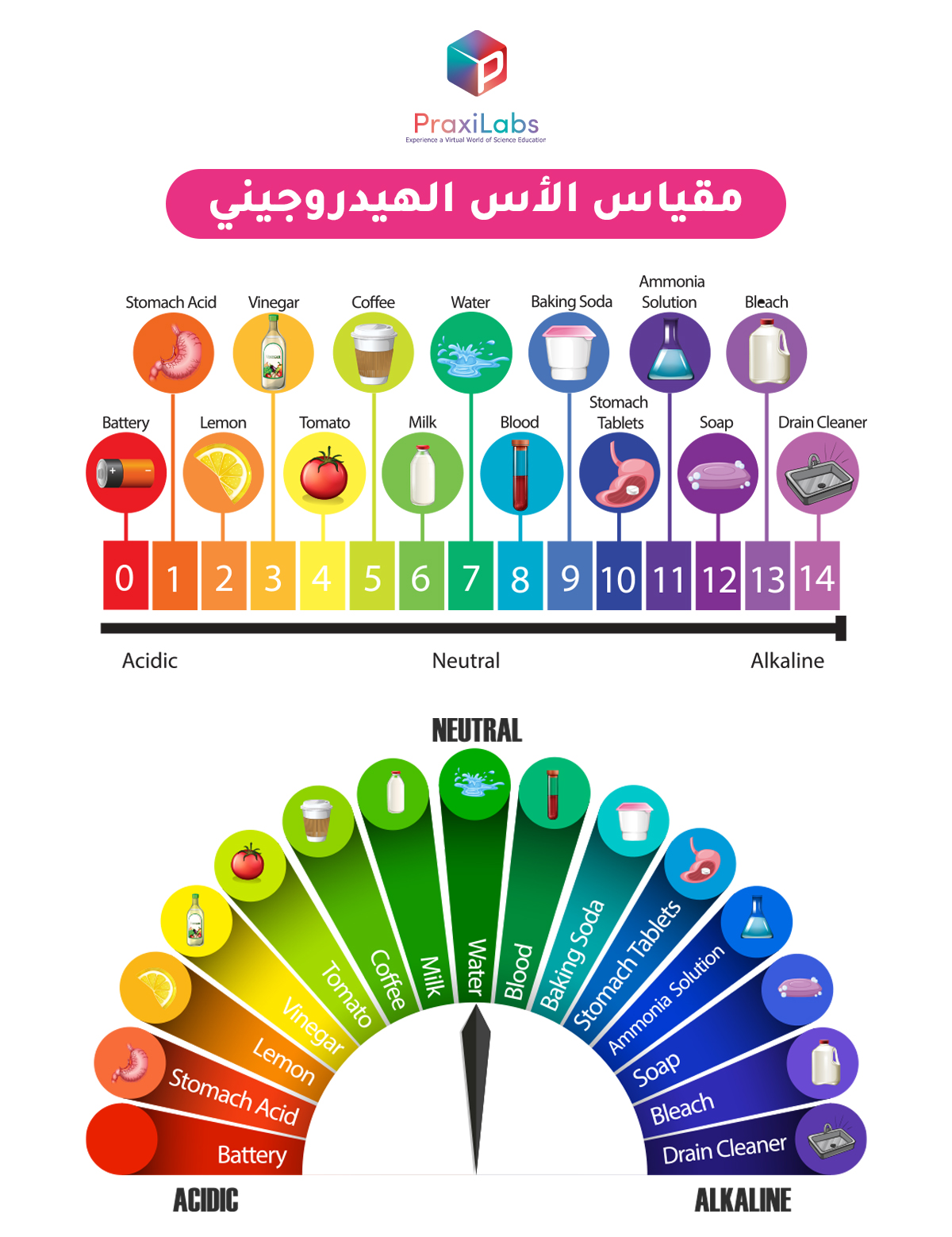
مقياس الرقم الهيدروجيني هو أداة رقمية يُستخدم للحصول على قياسات أكثر دقة للأس الهيدروجيني وبالتالي قياس درجة أو قوة الأحماض والقلويات. من خلال قياس نشاط أو تركيز أيون الهيدروجين في المحاليل. وتعتبر هذه الطريقة من أكثر دقة لقياس درجة (قوة) حموضة المحلول أو قاعديته.
يتراوح مقياس الرقم الهيدروجيني من 0 إلى 14:
- المحاليل التي يكون الرقم الهيدروجيني لها أقل من 7 تكون حمضية.
- المحاليل التي يكون الرقم الهيدروجيني لها أكبر من 7 تكون قاعدية.
- المحاليل التي يكون الرقم الهيدروجيني لها يساوي 7 تكون محايدة.
ملحوظة: بالنسبة للأحماض القوية جدا يمكن أن تكون قيمة الأس الهيدروجيني أقل من الصفر وبالنسبة للقواعد القوية جدا يمكن أن تكون قيمة الأس الهيدروجيني أكثر من 14.
- الأس الهيدروجيني 0 – 2: حمض قوي
- الأس الهيدروجيني 3 – 6: حمض ضعيف
- الأس الهيدروجيني 7: محايد
- الأس الهيدروجيني 8 – 11: قلوي ضعيف
- الأس الهيدروجيني 12 – 14: قلوي قوي
المؤشر العالمي
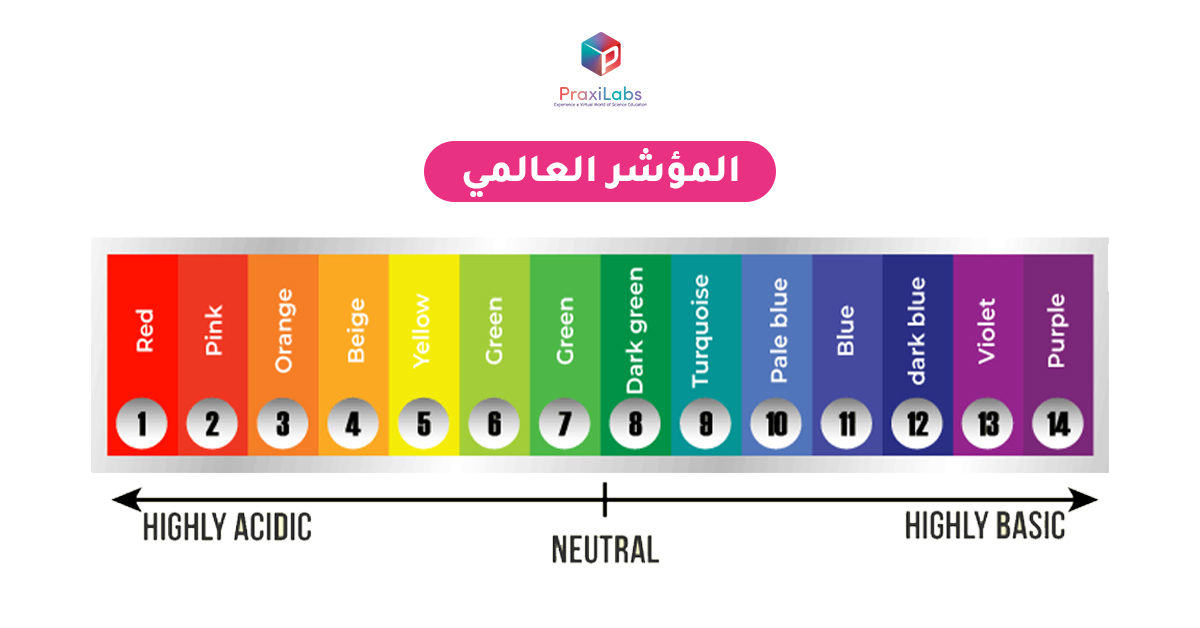
يعتبر المؤشر العالمي هو نسخة أكثر تقدمًا و دقة من ورق عباد الشمس ويوفر نطاق واسع من النتائج . يتكون من خليط من الأصباغ التي يتغير لونها تدريجياً اعتمادًا على الرقم الهيدروجيني للمحلول. يستخدم اللون للإشارة إلى الرقم الهيدروجيني مباشرة .
يعد هذا الخليط مهمًا لأن كل مكون من الخليط يفقد أو يكتسب إلكترونات اعتمادًا على حموضة أو قاعدية المحلول الذي يتم اختباره.
في المؤشر العالمي:
- تشير الألوان من الأصفر إلى الأحمر إلى محلول حمضي.
- تشير الألوان من الأزرق إلى البنفسجي إلى محلول قلوي.
- يشير اللون الأخضر إلى أن المحلول متعادل.
ما الذي يحدد قوة الحمض أو القاعدة؟
ثابت تفكك الحمض والقاعدة هو المقياس الذي يحدد قوة الحمض أو القاعدة، فكلما زاد ثابت التفكك كلما كان الحمض أو القاعدة أقوى.
بمعنى أخر، تعتمد قوة الحمض على عدد أيونات الهيدروجين الموجبة H+ في المحلول وتعتمد قوة القاعدة على عدد ايونات الهيدروكسيد السالبة OH- في المحلول. جميع الأحماض والقواعد لا تتأين أو تتفكك بنفس الدرجة وبالتالي فالأحماض والقواعد ليست جميعها متساوية في القوة (إنتاج أيونات هيدروجين H+ وهيدروكسيد OH- في المحلول).
بما أن الإلكتروليتات يتم إنتاجها عندما يتم تحرير الأيونات في المحلول، فهناك علاقة بين قوة الحمض والقاعدة والإلكتروليت الذي ينتجه. الأحماض القوية والقواعد القوية تصنع إلكتروليتات قوية. يتم قياس الأحماض والقواعد باستخدام مقياس الرقم الهيدروجيني. فمثلًا تتفكك الأحماض القوية تمامًا ويكون تركيز أيون الهيدروجين فيها أعلى، وتتفكك الأحماض الضعيفة جزئيًا ويكون تركيز أيون الهيدروجين فيها أقل.
أكتشف خطط الإشتراكات المتاحة لدي براكسيلابس

اكتشف تجربة في المختبر الافتراضي قوة الأحماض والقواعد
إذا كنت مهتمًا بإجراء تجربة في المختبر الافتراضي حول قوة الاحماض و القواعد، فيمكنك تجربة استخدام المختبرات الافتراضية التي توفر محاكاة ثلاثية الأبعاد تفاعلية وغامرة لكثير من موضوعات الكيمياء بما فيها قوة الاحماض والقواعد.
تجربة المقارنة بين قوي الأحماض والقواعد
في تجربة المقارنة بين قوى الأحماض باستخدام المختبر الإفتراضي وكذلك القواعد، ستتاح لك الفرصة لدراسة خصائص الأحماض والقواعد الضعيفة والقوية ومن ثم تقوم بقياس الأس الهيدروجيني للمحاليل، وقياس القوة المختلفة للأحماض والقواعد باستخدام المؤشر العالمي وتفسير النواتج.
بنهاية التجربة يكون الطالب قد اكتسب فهم أفضل للكيمياء (قوة الأحماض والقواعد) من خلال المحاكاة الافتراضية التي تعزز وتحسن نتائج التعلم على المدى الطويل، كما أنها توفر بيئة آمنة وتفاعلية لإجراء التجارب.
تذكر: أن على الرغم من أنه يتم إجراء التجربة في بيئة افتراضية، إلا أنه من الجيدة والهامة أن تتذكر احتياطات السلامة الواقعية عند العمل مع الأحماض والقواعد في المختبر الحقيقي. لا تنسى دائمًا ارتداء النظارات الافتراضية والتخلص من المواد الخطرة بطريقة صحيحة اثناء التعامل مع الأحماض والقواعد في المختبر الافتراضي.
في المختبرات الافتراضية للكيمياء وتحديدا دراسة الأحماض والقلويات، يمكنك أن تجد محاكاة افتراضية لما يلي:
- قياس مستويات الأس الهيدروجيني: ستتمكن من قياس الأس الهيدروجيني للمحاليل المختلفة وفهم الاختلافات بين الأحماض والقواعد وكذلك كيفية التمييز بينهم.
- تجربة المقارنة بين قوى الأحماض باستخدام المختبر الإفتراضي: ستتمكن من تحديد القوى المختلفة للأحماض وكيف تميز بينها.
- تجربة الكشف عن الأحماض والقواعد بالمختبر الإفتراضي : تستخدم هذه التجربة للتعرف على الأحماض والقواعد باستخدام طريقتين (مقياس ورق عباد الشمس ومقياس المؤشر العالمي).
- تجربة التعرف على بعض الشقوق الحمضية في أملاحها: يتم تحديد الشقوق الحمضية وتصنيفها وفق مجموعة من الاختبارات الكيميائية الأساسية والتوكيدية.
- تجربة التعرف على بعض الشقوق القاعدية في أملاحها: يتم تحديد الشقوق القاعدية وتصنيفها وفق مجموعة من الاختبارات الكيميائية الأساسية والتوكيدية.
بشكل عام، توفر المختبرات الافتراضية فرصة قيمة لاستكشاف قوة الأحماض والقواعد في بيئة آمنة وتفاعلية، مما يعزز فهم الطلاب لموضوعات الكيمياء الأساسية ويحسن نتائج التعلم.
اكتشف عالم مختبرات براكسيلابس الافتراضية في الكيمياء
في براكسيلابس، لا نقدم مجموعة واسعة من الميزات فحسب، بل نركز أيضًا على جعل هذه الميزات ذات قيمة. من قال أنه لا يمكن أن يكون لدينا الجودة والكمية؟ تتميز ميزاتنا الرئيسية باختلاف واضح عن المنافسين، من أجل توفير شيء يلبي كل الاحتياجات.
نحن نوفر لطلابنا مجموعة من أشهر تجارب الأحماض والقلويات مثل:
- المعمل الافتراضي لمعايرة الحمض القوي والقاعدة القوية
- المعمل الافتراضي لمعايرة القاعدة الضعيفة/الحمض القوي
- اختبار تحديد الشق الحمضي غير المعروف
- اختبار تحديد الشق القاعدي غير المعروف
أنضم إلى براكسيلابس مجاناً الآن!
 براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس
براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس






