تلعب الأحماض والقواعد دورا حيويا في حياتنا اليومية ونراها دائما حولنا؛ فمثلا عندما تنظف أسنانك بمعجون الأسنان أو تغسل يديك بالصابون أو تتناول قهوتك ، فأنت قد تعاملت بالفعل مع الأحماض والقواعد .
في الكيمياء، تصنف المواد على أنها أحماض أو قواعد أو محايدة ، اعتمادا على بعض الخصائص مثل درجة الحموضة والسلوك مع الماء. تصنف الأحماض والقواعد في الكيمياء إلى أحماض وقواعد ضعيفة وقوية، اعتمادا على القوة. في هذا المقال هو دليل او ملخص الأحماض والقواعد من حيث المفهوم وخصائصهم وأنواعهم وأمثلتهم وكذلك أشهر استخدامات الأحماض والقواعد في الصناعة.
مفهوم الأحماض والقواعد
يعتمد تقسيم المواد إلى أحماض وقواعد بشكل عام على:
- انتاج أيون الهيدروجين H+ أو أيون الهيدروكسيد OH- عند إذابتهم في الماء.
- نقل البروتون.
مفهوم الأحماض
الحمض هو مادة تنتج أيونات الهيدروجين (H+) عند إذابتها في الماء. يجب أن تحتوي الأحماض على أيون هيدروجين واحد على الأقل. تعتبر الأحماض مواد مانحة او متبرعة بالبروتونات.
مثال:
HCl (aq) ———– H+ (aq) + Cl- (aq)
يجب أن تحتوي الأحماض على بروتونات حمضية (H +) للتبرع بها واعتمادا على عدم وجود بروتونات حمضية، يمكن أن تكون الأحماض
- أحادية البروتون (على سبيل المثال: حمض الهيدروكلوريك وحمض النيتريك)
- ثنائية البروتون (على سبيل المثال: حمض الكبريتيك)
- ثلاثية البروتون (على سبيل المثال: حمض الفوسفوريك)
لاحظ أن:
- يمكن أن يعمل الماء كحمض عندما يتبرع ببروتون إلى قاعدة ويشكل أيون هيدروكسيد (OH-).
- الحمض الفائق هو حمض له درجة حموضة أكثر من حمض الكبريتيك النقي. بعض هذه الأحماض قادر على إنتاج أي شيء تقريبا، بما في ذلك الهيدروكربونات. مثال على الأحماض الفائقة هو حمض الفلوروسلفونيك HSO3F.
مفهوم القواعد
القاعدة هي مادة تحيد او تعادل الحمض لانتاج ملح وماء. تنقسم القواعد لتشكيل أيونات هيدروكسيد (OH- ) عند إذابتها في الماء (تسمى القاعدة التي تمت إضافتها إلى الماء المحلول القلوي). القواعد هي مستقبلات البروتونات ولقبول البروتونات ، يجب أن يكون لها زوج وحيد(زوج غير رابط) من الإلكتروات.
مثال:
NH3 + H + —————————– NH4+
يمكن أن تكون القواعد محايدة (على سبيل المثال: الأمونيا) أو سالبة الشحنة (على سبيل المثال: أيون الهيدروكسيد).
يمكن أن يعمل الماء كقاعدة عندما يقبل بروتون من حمض ويشكل أيون الهيدرونيوم H3O +.
يوفر المختبر الافتراضي للكيمياء ببراكسيلابس إمكانية دراسة مفاهيم الأحماض والقواعد
أطلب ديمو مجاني الآن! لتعش تجربة المعامل الإفتراضية
خصائص الأحماض والقواعد
سنعرض لكم الآن مقارنة بين خصائص الأحماض والقواعد:
أولاً: خصائص الأحماض
- تتميزالأحماض بطعم حامضي.
- تتفاعل مع بعض المعادن لفصل الهيدروجين.
- تتفاعل مع القواعد وتشكل الأملاح.
- تغيير لون ورق عباد الشمس من الأزرق إلى الأحمر.
- موصل تيار كهربائي جيد.
- يمكن أن تتلف الخلايا الحية.
- يمكنها تحفيز التفاعلات الكيميائية.
- قابلة للذوبان في الماء.
- الأحماض المعدنية عديمة اللون وفي الحالة الصلبة ، تكون الأحماض العضوية بيضاء.
- يشيع استخدامها في بطاريات السيارات والأسمدة.
أمثلة: الخل (حمض الخليك) / حمض الهيدروكلوريك / حمض الكبريتيك.
ثانياً: خصائص القواعد
- تتميز القواعد بملمس صابوني ويمكن أن تغير بنية البروتين.
- تتفاعل مع الأحماض وتشكل الأملاح.
- تغيير لون ورق عباد الشمس من الأحمر إلى الأزرق.
- موصل تيار كهربائي جيد.
- القواعد القوية يمكن أن تتلف بروتينات الجلد وتسبب حروقا شديدة.
- مواد المسببة للتآكل التي يمكن أن تلحق الضرر بالمواد الأخرى.
- بعض القواعد قابلة للذوبان في الماء ولكن البعض الآخر ليس كذلك.
- معظم القواعد عديمة اللون.
- يشيع استخدامها في العديد من منتجات التنظيف.
أمثلة: الأمونيا / هيدروكسيد الصوديوم / هيدروكسيد البوتاسيوم
الفرق بين الأحماض والقواعد
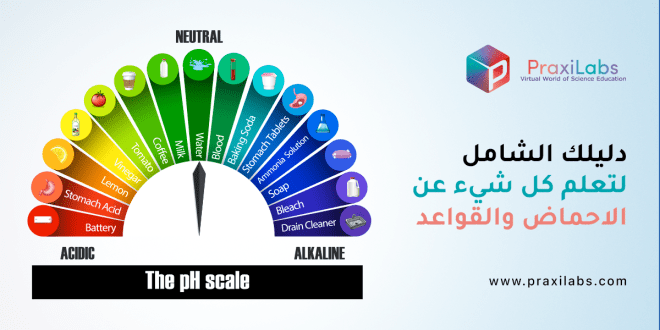
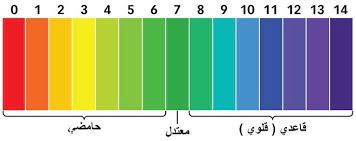
الفرق الرئيسي بين الأحماض والقواعد هو قيمة الرقم الهيدروجيني لكل منها. ففي الأحماض درجة الحموضة تكون أقل من 7 وفي القواعد الرقم الهيدروجيني يكون أعلى من 7.
الرقم الهيدروجيني هو مقياس لحموضة أو قلوية محلول على مقياس لوغاريتمي يكون فيه 7 محايداً، والقيم الأعلى أكثر قلوية والقيم الأقل أكثر حمضية. الرقم الهيدروجيني يساوي -log10 c،
حيث c هو تركيز أيون الهيدروجين في المولات لكل لتر.
تحديد وقياس الأحماض والقواعد
عندما نختبر مادة ما باستخدام مقياس الأس الهيدروجيني، نحصل على رقم من صفر إلى 14. هذا مقياس الأس الهيدروجيني ، ويمكن استخدامه لمقارنة المواد، وكذلك تحديد وقياس الأحماض والقواعد. لاحظ أن مقياس الأس الهيدروجيني لوغاريتمي مما يعني أن مقدار 1 انخفاض في مقياس الأس الهيدروجيني يمكن أن يسبب زيادة 10 مرات في تركيز أيونات الهيدروجين.
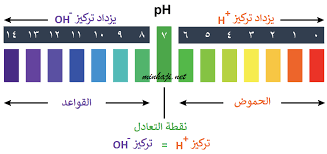
الأحماض يكون قيمة الرقم الهيدروجيني لها أقل من 7. كلما زاد عدد أيونات الهيدروجين H +، زادت حموضتها وانخفضت قيمة الرقم الهيدروجيني. أما القواعد تكون قيمة الرقم الهيدروجيني لها أعلى من 7. عندما يكون هناك توازن بين ايونات H+ و OH- ، يطلق عليه محايد وتكون قيمة الرقم الهيدروجيني هي 7.
بالنسبة للأحماض القوية جدا، يمكن أن تكون قيمة الرقم الهيدروجيني أقل من الصفر وبالنسبة للقواعد القوية جدا، يمكن أن تكون قيمة الرقم الهيدروجيني أكثر من 14.
مقياس الأس الهيدروجيني
- الأس الهيدروجيني 0 – 2: حمض قوي
- الأس الهيدروجيني 3 – 6: حمض ضعيف
- الأس الهيدروجيني 7: محايد
- الأس الهيدروجيني 8 – 11: قلوي ضعيف
- الأس الهيدروجيني 12 – 14: قلوي قوي
في المختبرات الافتراضية من براكسيلابس ، يمكنك أداء تجارب علمية افتراضية في كل فروع العلوم
أنضم إلى براكسيلابس مجاناً الآن!
أمثلة على الأحماض والقواعد (رموز الأحماض والقواعد)
يوضح الجدول التالي قائمة بأشهر أمثلة على الأحماض والقواعد و رموزها الكيميائية:
| الأحماض | القواعد |
|
H2SO4- حمض الكبريتيك KOH – هيدروكسيد البوتاسيوم HCLحمض الهيدروكلوريك CH3COOH – حمض الخليك HNO3 – حمض النيتريك HBr – حمض الهيدروبروميك H2CO3 – حمض الكربونيك HI – حمض الهيدرويوديك H2CO3 – حمض الكربونيك |
KOH- هيدروكسيد البوتاسيوم NaOH – هيدروكسيد الصوديوم Li(OH)2 – هيدروكسيد الليثيوم Ca(OH)2 – هيدروكسيد الكالسيوم Ba(OH)2 – هيدروكسيد الباريوم C5H5N – بيريدين HCO3 – أيون بيكربونات NH3 – الأمونيا |
أنواع الأحماض الكيميائية
تنقسم الأحماض طبقا لقوتها الى أحماض قوية وأحماض ضعيفة
أولاً: الأحماض القوية
يتميز الحمض القوي بقدرته على التأين أو الانفصال تماما في المذيبات. قيمة( pKa) ثابت تأين الحمض للأحماض القوية أقل من -2.
ملاحظة: عندما تصبح الأحماض القوية أكثر تركيزا، قد تكون غير قادرة على الذوبان الكامل. يتم فصل الحمض القوي بالكامل في محاليل بتركيز 1.0 م أو أقل.
الشكل العام لتفاعل التفكك أو التأين للأحماض القوية هو:
HA + S ↔ SH+ + A-
حيث: S هو جزيء المذيب مثل الماء
على سبيل المثال، تفكك حمض الهيدروكلوريك في الماء:
HCl(aq) → H+(aq) + Cl-(aq)
Ka هو ثابت تفكك الحمض ويقيس مدى انفصال الحمض تماما في محلول. تشير القيمة الكبيرة لـ Ka إلى أن الحمض منفصل للغاية إلى أيوانه وهو حمض قوي. الأحماض القوية لها قيمة صغيرة من Ka لأنها تنفصل تماما في الماء.
هناك علاقة مباشرة بين Ka و pKa (ثابت تفكك الحمض اللوغاريتمي). لذلك، كلما كان الحمض أقوى كلما انخفضت قيمة pKa.
pKa = -log [Ka]
تعتمد قيمة pKa للحمض على المذيب. على سبيل المثال ، تبلغ قيمة pKa لحمض الهيدروكلوريك حوالي -5.9 في الماء وفي ثنائي ميثيل سلفوكسيد حوالي -2.0 ، في حين أن قيمة pKa لحمض الهيدروبروميك حوالي -8.8 في الماء وفي ثنائي ميثيل سلفوكسيد حوالي -6.8.
أمثلة على الأحماض القوية:
- H2SO4 (حمض الكبريتيك)
- HNO3 (حمض النيتريك)
- حمض الهيدروكلوريك (HCl)
- HI (حمض الهيدرويوديك)
- HBr (حمض الهيدروبروميك)
- HClO3 (حمض الكلوريك)
- HClO4 (حمض البيركلوريك)
- حمض التريفليك (H[CF3SO3])
ثانياً: الأحماض الضعيفة
عندما تذوب الأحماض الضعيفة في الماء ، يحدث توازن بين تركيزات الحمض الضعيفة والأيونات المكونة لها، لذلك يمكننا القول أن الأحماض الضعيفة ليست متأينة بالكامل في المحلول.
على سبيل المثال، يعتبر حمض الهيدروفلوريك HF حمضا ضعيفا. عندما تذوب في الماء، توجد أيواتها في حالة توازن مع أيونات الهيدروجين، التي تتفاعل مع الماء لتشكيل الهيدرونيوم، وأيونات الدقيق. نظرا لأن الأحماض لا تنفصل تماما إلى مكوناتها الأيونية، فإنها تسمى الحمض الضعيف في هذه الحالة.
HA + H2O ⇌ H3O+ + A–
أنواع القواعد
أولاً: القواعد القوية
تتميز القاعدة القوية بقدرتها على التأين الكامل أو الانفصال إلى أيونات خاصة بها.
القواعد القوية الأكثر شيوعا هي هيدروكسيدات المعادن لأنها تتكون من معدن يرتبط أيونيا مع أيون الهيدروكسيل OH− ، مثل هيدروكسيد البوتاسيوم KOH.
تعتبر القواعد القوية بمثابة مستقبلات جيدة للبروتونات التي لا يمكن أن تبقى في محلول مائي. على سبيل المثال ، يتم تحويل جميع أيونات الأكسجين إلى أيونات هيدروكسيد عن طريق استقبال البروتونات من جزيئات الماء H2O. نتيجة لذلك ، يتم تحويل جزيئات الماء إلى هيدروكسيد OH-. لاحظ أن كاتيونات القواعد القوية قابلة للذوبان في الماء (إذا كان الكاتيون قابلا للذوبان في الماء ، فيمكن أن يشكل قاعدة قوية).
مثال: BOH + H2O → B + (aq) + OH–(aq)
pOH هو سالب أس اللوغاريتم العشري لجزيئات الهيدروكسيد النشطة OH و هو قياس لتركيز أيون الهيدروكسيد (OH-). كلما زاد تركيز أيونات الهيدروكسيد في المحلول ، انخفضت قيمة pOH وبالتالي ، قاعدة أقوى.
pOH = -log [OH–]
عادة ما يكون للقواعد القوية قيمة الرقم الهيدروجيني بين 13 و 14.
Kb أو ثابت تفكك القاعدة يقيس مدى تأين القاعدة أو انفصالها تماما في محلول. تشير القيمة الكبيرة ل Kb إلى قاعدة قوية وتعني أيضا أن القاعدة منفصلة للغاية في أيوناتها.
هناك علاقة مباشرة بين Kb و pKb (ثابت تفكك القاعدة اللوغاريتمية). لذلك ، كلما كان الحمض أقوى كلما انخفضت قيمة pKb.
pKb = -log [Kb]
توضح المعادلة التالية العلاقة بين الرقم الهيدروجيني والرقم الهيدروجيني لمحلول مائي:
pH + pOH = 14
إذا كانت قيمة pOH أو الرقم الهيدروجيني للمحلول معروفة ، فيمكنك حساب الآخر.
أمثلة على القواعد القوية:
- KOH (هيدروكسيد البوتاسيوم)
- LiOH (هيدروكسيد الليثيوم)
- NaOH (هيدروكسيد الصوديوم)
- Ca(OH)2 (هيدروكسيد الكالسيوم)
- Ba(OH)2 (هيدروكسيد الباريوم)
- RbOH (هيدروكسيد الروبيديوم)
- Sr (OH) 2 (هيدروكسيد السترونتيوم)
- CsOH (هيدروكسيد السيزيوم)
ثانياً: القواعد الضعيفة
القاعدة الضعيفة هي قاعدة لا يمكنها تأين أيونات الهيدروجين بالكامل أو قبولها بالكامل في المحلول. تحتاج القاعدة إلى الانفصال في محلول حتى تتفاعل مع الحمض لتشكيل زوج قاعدة حمضي؛ إذا لم تقتحم القاعدة الأيونات المكونة لها، فلن تكون قادرة على التفاعل بالطريقة التي ينبغي أن تتفاعل بها. عند إذابته في الماء ، يحتوي المحلول على كمية صغيرة من أيونات الهيدروكسيد وكمية كبيرة من القاعدة غير المنفصلة.
على سبيل المثال ، مع هيدروكسيد الأمونيوم ، NH4OH ، فإن نظير القاعدة هو NH4 + و OH-؛ من المفترض أن يقبل NH4 + الهيدروجين الحمضي في المحلول؛ ومع ذلك ، في قاعدة ضعيفة ، لا ينفصل هذا الأيون تماماً، لذلك هناك خليط من NH4OH وزوج القاعدة الحمضية.
B + H2O ⇌ BH+ + OH-
استخدامات الأحماض والقواعد في الصناعة
أكثر الأحماض شيوعاً واستخداماً في الصناعة هو حمض الكبريتيك؛ فهو يستخدم في إنتاج الاسمدة الكيمائية وصناعة المطاط والنظفات والبلاستيك والكحولات وبطاريات السيارات ويدخل في صناعة النحاس والحديد ايضا.
- حمض الفوسفوريك يتم استخدامه في المنظفات والأسمدة الفوسفاتية.
- يستخدم حمض الهيدروكلوريك لتنظيف الصفائح المعدنية (صناعة الصلب).
- يستخدم حمض النيتريك في العديد من الصناعات كالمتفجرات و الأسمدة النتراتية .
يتم استخدام هيدروكسيد الصوديوم في صناعة الورق (لإزالة اللجنين من لب الورق ) ويستخدم ايضا كعامل كيميائي لتقشير الفواكة في الصناعات الغذائية.
يقدم براكسيلابس معامل افتراضية في أفرع الكيمياء المختلفة حيث يوجد أكثر من ٤٥ تجربة مختلفة
 براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس
براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس