في الحياة، لا شئ يحدث عشوائياً أو بدون سبب. حتى تلك الأحداث الضئيلة – في نظرك – كُلُها معتمدة إعتماداً كاملاً على قوانين الطبيعة. فكل شئٍ يحدث لسبب، ووفقاً لقوانين حازمة، لا تسمح للعشوائية أن تسيطر على هذا الكون. لذلك يدور مقالنا هذا عن:
بعض التطبيقات التي تحدث في حياتنا، ونعتقد انها عشوائية، ولكنها معتمدة على قانون من أهم القوانين الفيزيائية وهو: قانون بويل (تطبيقات على قوانين الغازات في الحياة العملية)
وفي آخر هذا المقال سيكون هناك محاكاة ثلاثية الأبعاد في معمل الفيزياء ببراكسيلابس لإثبات قانون بويل.
أكتشف خطط الإشتراكات المتاحة لدي براكسيلابس
من هو بويل؟
بويل هو عالم كيميائي وفيزيائي وأيضاً مخترع. بالرغم من أنه عانى من مرضٍ خطير أثر على نظرهُ بشكل دائم، إلا أنه تغلب على مرضه وقام بتعيين بعض الأشخاص لكتابة أفكاره بدلاًعنه. فأصبح – رغماً عن مرضه – أول من وضع حجر الأساس في قوانين الغازات.
كما يعتبر أول من اكتشف قانوناً يعبر عن سلوك الغازات، فأحدث اكتشافه طفرة في علم الفيزياء، وسُمي القانون بقانون بويل نسبة إليه. يعتبر بويل أحد مؤسسي الكيمياء الحديثة.
العجيب من أمره انه لم يلتحق بصورة رسمية بأي جامعة، فقد كان ثرياً لدرجة جعلته يقوم بكامل أبحاثه على نفقته الخاصة. ورغم إنجازات وإكتشافات علم الفيزياء الخاص به إلا أن مادته المفضلة كانت الكيمياء.
كيف اكتشف بويل القانون الأول للغازات -(قانون بويل) ؟
في عام 1654 اخترع العالم الفيزيائي الألماني (أوتو فون غيريكه) أول انبوبة مفرغة. فعندما علم بها بويل فُتن بها. ناقش بويل هذا الاختراع مع صديقه روبرت هوك. عَمِلَ هوك على تحسين هذه الأنبوبة المفرغة. وبدأ بويل وهوك في اكتشاف خصائص الهواء والفراغ بإستخدام تلك الأنبوبة.
أثناء قيام بويل وهوك ببعض التجارب، اكتشفا أعظم اكتشاف في حياتهما. وهو ما يسمى الآن بـ ” قانون بويل”. حيث قاما بتغيير الضغط على وزن ثابت من الهواء باستخدام الزئبق، فأكتشف بويل أنه كلما ازداد الضغط على الهواء يقل حجمه. ومن هنا جاء نص قانون بويل.
ما هو نص قانون بويل (مبدأ بويل) وما هي أهميته؟
نص قانون بويل على انه إذا تغير الضغط على كمية معينة من الغاز، فإن حجمه يتناسب عكسيا مع تغير الضغط، بشرط “ثبوت درجة الحرارة”.
ووصف القانون بالعلاقة الرياضية PV=K . واصبح قانوناً اساسياً في الكيمياء.
أهمية قانون بويل تكمن في كونه: أول قانون يصف سلوك الغازات، حيث أوضح أن الغازات تنتشر في الوسط، اي يزداد حجمها اذا قل الضغط عليها (تبعد الجزيئات عن بعضها وتتحرك بسهولة)، والعكس صحيح – فإذا ما ضُغط الغاز بشدة، اقتربت جزيئاته من بعضها البغض، مسببةً تقلص الحجم.
تطبيقات قانون بويل
إليكم تطبيقات حياتية مختلفة على قانون بويل:
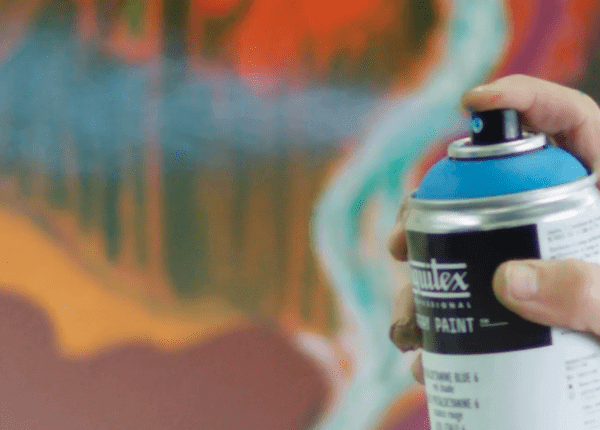
بخاخة الطلاء
تعتمد بخاخات الطلاء او بخاخات الرذاذ عموماً على قانون بويل، حيث تحتوي علبة الطلاء على مادتين، إحداهما هي مادة الطلاء نفسها، والمادة الأخرى هي غاز مضغوط في شكل سائل داخل العلبة.
بالرغم من أن درجة غليان الغاز المسال أقل من درجة حرارة الغرفة، إلا أنه فعلياً لا يغلي بداخل العلبة، ولا يتحول لحالته الغازية، لأن العلبة تكون محكمة الغلق.
بمجرد ان تقوم بضغط البخاخ ويبدأ الغاز في الخروج من العلبة، تبدأ حالة الغليان ويتمدد الغاز المسال ويتحول الى حالته الغازية ويقوم بالضغط على مادة الدهان داخل العلبة، فتندفع مادة الدهان الى أعلى للخروج من فوهة البخاخ مع هروب الغاز من العلبة.
زجاجة المياة الغازية
في حالة زجاجات المياة الغازية. جميعنا يقوم بتطبيق قانون بويل، ولكن بشكل غير مقصود. فنلاحظ أنه إذا قام شخص بفتح زجاجة المياة الغازية بسرعة يندفع غاز من كل مكان، وربما تخرج المياة الغازية على هيئة فوم مسببة فوضى عارمة. فما هو سبب حدوث تلك الفوضى؟
تحدث تلك الفوضى لأن الصودا يتم ضخها إلى زجاجة المياة الغازية عن طريق تمرير السائل على غاز ثاني اكسيد الكربونن. فعندما يتم فتح الزجاجة “اي انك تقوم فعلياً بتقليل الضغط على الغاز” فإن حجم الغاز يتمدد. فإذا تم فتح الغطاء بسرعة فإن ذلك يؤدي لحدوث اندفاع شديد للغاز إلى خارج الزجاجة، لذلك يجب ان يتم فتح الغطاء ببطئ وحرص حتى يخرج الغاز بهدوء.

فوران المياة الغازية
نواجه ظاهرة اخرى في حالات المياه الغازية وهي: فوران المياه الغازية إذا تعرضت للرج أو الاهتزاز، فماذا يحدث في هذه الحالة؟
يختلط الغاز مع السائل داخل الزجاجة نتيجة للرج، فعندما يبدأ أحدهم بفتح الغطاء، يحاول الغاز الهروب من الزجاجة، ولكن بسبب اختلاطه مع السائل فإن الغاز يجلب معه السائل ويخرجا معاً، متحولين الى فوم (رغوة) وتحدث الفوضى!
الغوص في المياة العميقة
يعلم كل غواص تمام العلم أنه أثناء الصعود من مياه عميقة، فإن الصعود ببطء هو أمر لا تهاون فيه. فأجسامنا مبنية ومخصصة للعيش في الضغط الطبيعي، وزيادة الضغط تسبب العديد من المشاكل. واليكم السبب وراء ضرورة الصعود ببطء.
كلما يتحرك الغواص لأسفل متجهاً الى قاع المياه فإن الضغط يزداد، وزيادة الضغط تؤدي إلى نقص الحجم، فيبدأ دم الغواص بامتصاص غاز النيتروجين. ويحدث العكس عندما يبدأ الغواص في الصعود مرة اخرى، فتبدأ جزيئات غاز النيتروجين في التمدد والرجوع إلى حجمها الطبيعي.
فإذا التزم الغواص بالصعود ببطء، فإن جزيئات غاز النيتروجين تتمدد وترجع إلى حالتها الطبيعية بدون مشاكل. ولكن اذا صعد بسرعة فإن دم الغواص يتحول الى فوم وتحدث نفس الفوضى التي تحدث في المياه الغازية مما يتسبب في انحناءات متتالية للغواص، ويشعر أثنائها بألم شديد.
وفي أسوأ الحالات، يمكن لهذا الإنخفاض في الضغط المفاجئ للجسم أن ينهي حياة الغواص على الفور.
تطبيقات قانون بويل في الطب
تُعتبر الحُقنة الطبية مثالاً على قانون بويل، وهي اداة طبية تستخدم لحقن أو سحب السوائل، تتكون من أسطوانة مجوفة تسمى برميل ومكبس منزلق متصل بها.
مبدأ عمل الحقنة يشبه المضخة الترددية، عندما يتم دفع المكبس سيحقن السائل وعندما يتم سحب المكبس سوف ينسحب السائل، يؤدي دفع المكبس إلى تقليل حجم السائل في البرميل، لذلك يؤدي هذا الانخفاض في الحجم إلى زيادة مؤقتة في ضغط السائل، ويتم حقن السائل في جسم المريض، وبطريقة مماثلة يؤدي سحب المكبس إلى زيادة حجم السائل ينتج عنه انخفاض مؤقت في ضغط السائل ويتم سحب السائل الخارجي.
فيديو تطبيقي على قانون بويل
وفي الفيديو التالي توضيح لتغيبر الحجم كلما زاد الضغط تحت مستوى سطح البحر.
تجربة لإثبات قانون بويل في معمل الفيزياء ببراكسيلابس.
بعد ان تعرفنا على بويل، وقانونه الأول للغازات، وتطبيقاته الحياتية، نشكرك على قرائتك للمقال حتى نهايته، وندعوك إلى القيام بإجراء محاكاة ثلاثية الأبعاد لإثبات قانون بويل داخل المعامل الافتراضية في براكسيلابس والتي ستتعرف من خلالها على الغرض من تجربة قانون بويل وخطوات العمل و المبدأ وكذلك أدوات تجربة قانون بويل.
خطوات الدخول إلى التجربة:
- إنشاء حساب مجاني
- اضغط علي My account
- اضغط على 3D simulations
- اضغط على Physics
- أختر Boyle’s Law
وأخيراً نتمنى لكم تجربة ممتعة بمعاملنا. لا تتردد في اخبارنا كيف كانت تجربتك مع براكسيلابس.
 براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس
براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس







