هل تسائلت يومًا عن ” المصادر الرئيسية للطاقة على هذا الكوكب، سواء كانت طبيعية أو بيولوجية أو صناعية ؟” “ما التفاعلات التي تسمح باستخراج الطاقة من الجزيئات؟” “ما المسؤول عن التنفس الخلوي والتمثيل الضوئي؟” “ما السبب وراء تكون المعادن وتجمعها وتغير ألوان الصخور؟”
الجواب هو “تفاعلات الأكسدة والاختزال” والتي تعتبر أهم تفاعلات في حياتنا.
في هذه المقالة، سنناقش تفاعلات الأكسدة والاختزال، ماهي وأشهر الأمثلة عليها وكذلك تطبيقاتها في حياتنا اليومية.
تفاعلات الأكسدة والاختزال في كل مكان حولنا. في الواقع، تعتمدعلى الكثير من التكنولوجيا حولنا، بدأً من النار إلى بطاريات الكمبيوتر المحمول، وصولا ً إلى حد كبير على تفاعلات الأكسدة والاختزال. تحدث تفاعلات الأكسدة والاختزال إما من خلال عملية بسيطة، مثل حرق الكربون في الأكسجين لإنتاج ثاني أكسيد الكربون (CO2) ، أو عملية أكثر تعقيدًا مثل أكسدة الجلوكوز (C6H12O6) في جسم الإنسان من خلال سلسلة من عمليات نقل الإلكترون.
جرب تفاعلات الأكسدة والإختزال من خلال معامل براكسيلابس الإفتراضية
تعريف تفاعلات الأكسدة والاختزال
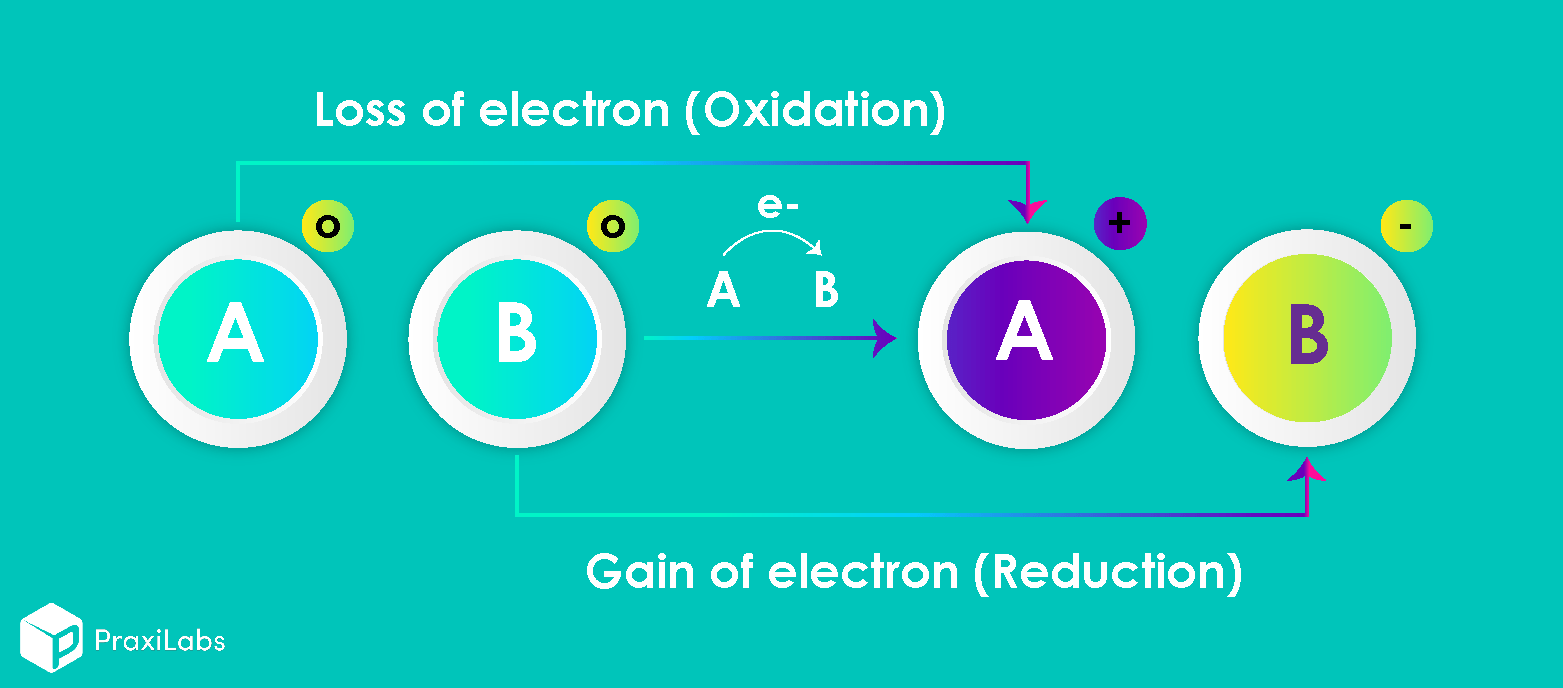
تفاعلات الأكسدة والاختزال هي نوع من التفاعلات الكيميائية التي تشمل نقل الإلكترونات بين نوعين. وهي أي تفاعل كيميائي يتغير فيه رقم تأكسد الجزيء أو الذرة أو الأيون باكتساب إلكترون (Gain of electron) أو فقدان إلكترون (Lose of electron). فتفاعلات الأكسدة والاختزال شائعة وحيوية لبعض الوظائف الأساسية للحياة، بما في ذلك البناء الضوئي، والتنفس الخلوي، والاحتراق، والتآكل أو الصدأ.
كما إنها تعتبر فئة من التفاعلات التي تشمل:
– تكوين مركب من عناصره.
– جميع تفاعلات الاحتراق.
– التفاعلات التي تولد الكهرباء.
– التفاعلات التي تنتج الطاقة الخلوية.
مبادئ تفاعلات الأكسدة والأختزال
يمكن شرح الاكسدة والاختزال على أن:
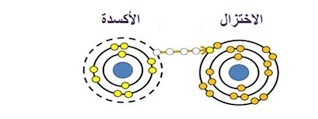
الأكسدة: فقدان الإلكترونات لعامل مؤكسد (يخضع للاختزال) لإنتاج حالة أكسدة أعلى.
مثال:
Fe+2 (ferrous ion) ——- Fe+3 (ferric ion)
الاختزال: اكتساب الإلكترونات من عامل الاختزال (الذي يخضع للأكسدة) لإعطاء حالة أكسدة أكثر أو أقل.
شرح معادلات الأكسدة والاختزال
يطلق على النوعين اللذين يتبادلان الإلكترونات في تفاعل الأكسدة والاختزال أسماء خاصة. يسمى الأيون أو الجزيء الذي يقبل أو يكتسب الإلكترونات بالعامل المؤكسد. عن طريق قبول الإلكترونات، فإنه يسبب أكسدة أنواع أخرى. على العكس من ذلك ، فإن الأنواع التي تفقد أو تتبرع بالإلكترونات تسمى العامل المختزل؛ عندما يحدث التفاعل، فإنه يقلل من الأنواع الأخرى. بمعنى آخر، ما هو مؤكسد هو العامل المختزل وما ينقص هو العامل المؤكسد. (ملاحظة: يمكن أن تكون العوامل المؤكسدة والاختزال نفس العنصر أو المركب).
هناك بعض القواعد لتحديد رقم التأكسد في نفاعلات الأكسدة والاختزال:
– رقم التأكسد للذرة في شكلها العنصري (مثال: O2) يساوي صفر.
– رقم التأكسد في حالة أيون أحادي الذرة يساوي شحنة الأيون.
– مجموع قيم أرقام تأكسد الذرات في الجزيء أو وحدة صيغة المركب تساوي صفرًا (يساوي شحنة الأيون إذا كان أيون متعدد الذرات).
شرح وزن معادلات الأكسدة والاختزال
عند موازنة تفاعلات الأكسدة والاختزال، تأكد أن عدد الإلكترونات التي فقدها عامل الاختزال يساوي عدد الإلكترونات المكتسبة بواسطة العامل المؤكسد.
يمكن استخدام طريقتين:
-
طريقة رقم الأكسدة
- قم بتعيين أرقام الأكسدة لجميع العناصر في التفاعل.
- من التغييرات في أرقام التأكسد، حدد الأنواع المؤكسدة و المختزلة.
- احسب عدد الإلكترونات المفقودة في الأكسدة والتي اكتسبت في الاختزال من التغييرات في أرقام الاكسدة.
- اضرب أحد هذين الرقمين أو كلاهما في العامل أو العدد المناسب الذي يجعل الإلكترونات المفقودة تساوي الإلكترونات المكتسبة ، واستخدام العوامل كمعاملات موازنة.
- أكمل الموازنة عن طريق الفحص ، مضيفًا حالات المواد.
-
طريقة نصف التفاعل
- قسّم التفاعل إلى نصفين من التفاعلات، كل منهما يحتوي على الأشكال المؤكسدة والمختصرة لأحد عناصر التفاعل.
- قم بموازنة الذرات والشحنات في كل نصف تفاعل.
- الذرات متوازنة بالترتيب التالي : ذرات غير الاكسجين والهيدروجين، ثم الاكسجين والهيدروجين.
- تتم موازنة الشحنة بإضافة الإلكترونات.
- إلى اليسار في تفاعلات نصف الاختزال ، و إلى اليمين في تفاعلات نصف الأكسدة.
- إذا لزم الأمر، اضرب أحد نصفي التفاعل أو كلاهما في عدد صحيح؛ لجعل عدد الالكترونات المكتسبة يساوي عدد الالكترونات المفقودة.
- أضف نصف التفاعلات المتوازنة، وقم بتضمين حالات المادة في المعادلة.
- تأكد من أن الذرات والشحنات متوازنة.
مثال على تفاعلات الأكسدة والاختزال
سنتناول المثال التالي لشرح وزن معادلات الاكسدة والاختزال:
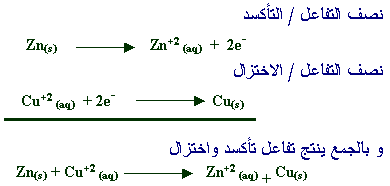
في التفاعل بين الهيدروجين والفلور ، يتأكسد الهيدروجين ويتم تقليل الفلور:
H2 + F2 → 2 HF
يكون هذا التفاعل تلقائيًا ويطلق 542 كيلو جول لكل 2 جم من الهيدروجين لأن رابطة H-F أقوى بكثير من رابطة F-F الضعيفة والعالية الطاقة. يمكننا كتابة التفاعل الكلى هذا على هيئة أنصاف تفاعلات كالاتي:
تفاعل الأكسدة
-H2 → 2 H + 2 e
تفاعل الاختزال
-F2 + 2 e- → 2 F
العناصر، حتى في الشكل الجزيئي لها دائمًا حالة أكسدة صفرية. في أول نصف تفاعل، يتأكسد الهيدروجين من حالة أكسدة صفر إلى حالة أكسدة +1. وفي نصف التفاعل الثاني، يتم تقليل الفلور من حالة أكسدة صفر إلى حالة أكسدة −1.
عند إضافة التفاعلات معًا، يتم إلغاء الإلكترونات وتتحد الأيونات لتكوين فلوريد الهيدروجين:
2H + 2F− → 2HF
فيصبح التفاعل الكلي:
H2 + F2 → 2 HF
أنواع تفاعلات الأكسدة والاختزال
يمكننا تصنيف أنواع تفاعلات الأكسدة والاختزال وفقًا للعمليات المتضمنة في التفاعل ووصف ما يحدث لمكوناتها المختلفة إلى:
تفاعلات الدمج Combination
التفاعلات الدمج “تجمع” العناصر لتشكيل مركب كيميائي. مع حدوث الأكسدة والاختزال معًا كالعادة.
على سبيل المثال:
2H2 + O2 → 2 H2O
مجموع حالات الأكسدة في المواد المتفاعلة يساوي تلك الموجودة في نواتج التفاعل
(2)(+1) + (-2) → 0 + 0
في هذه المعادلة ، كلا H2 و O2 هي الأشكال الجزيئية للعناصر الخاصة بها، وبالتالي فإن حالات الأكسدة الخاصة بها هي 0. ناتج التفاعل هو H2O وحالة الأكسدة هي -2 للأكسجين و +1 للهيدروجين.
تفاعلات الانحلال Decomposition
تفاعلات الانحلال هي عكس التفاعلات الدمج، مما يعني أنها تكسر المركب الكيميائي إلى العناصر المكونة له.
على سبيل المثال:
2H2O → 2 H2 + O2
0 + 0 → 0=(2-)+(1+)(2)
في هذه المعادلة يتحلل الماء إلى هيدروجين وأكسجين، وكلاهما متعادل. على غرار المثال السابق، تمتلك H2O حالة أكسدة كلية قدرها 0 ، حيث تأخذ كل هيدروجين H حالة +1 و كل اكسجين O -2؛ وبالتالي، يؤكسد التحلل الأكسجين من -2 إلى 0 ويختزل الهيدروجين من +1 إلى 0.
تفاعلات الاحلال Displacement
تفاعلات الاحلال والمعروفة أيضًا باسم تفاعلات الاستبدال ، تتضمن “استبدال” العناصرو تحدث على شكل تفاعلات استبدال بسيطة ومزدوجة.
- تفاعل الاحلال البسيط “يستبدل” عنصرًا في المواد المتفاعلة بعنصر آخر في نواتج التفاعل .
على سبيل المثال:
Cl2 + 2 NaBr → 2 NaCl + Br2
في هذه المعادلة، يتم اختزال الكلور Cl ويستبدل البروم Br ، بينما يتأكسد البروم.
- تفاعل الاحلال المزدوج مشابه لتفاعل الاحلال البسيط، ولكنه يتضمن “استبدال” عنصرين في المواد المتفاعلة بعنصرين في النواتج.
على سبيل المثال:
Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O
تفاعلات الاحتراق Combustion
تشتمل تفاعلات الاحتراق دائمًا على الأكسجين والوقود العضوي.
مثال :تفاعل احتراق الميثان
هذا مثال على تفاعل الاحتراق ، عملية الأكسدة والاختزال. يتفاعل الميثان مع الأكسجين لتكوين ثاني أكسيد الكربون واثنين من جزيئات الماء.
تفاعلات عدم تناسب Disproportionation
في بعض تفاعلات الأكسدة والاختزال، يمكن للمواد نفسها أن تتأكسد وتختزل. تُعرف هذه باسم تفاعلات عدم التناسب. أحد الأمثلة على هذه العملية هو تفاعل بيروكسيد الهيدروجين H2O2 عندما يُسكب على الجرح. في البداية ، قد يبدو هذا وكأنه تفاعل احلال بسيط ، لأن بيروكسيد الهيدروجين يتحلل لإنتاج الأكسجين والماء:
2 H2O2 (aq.) → 2 H2O (l) + O2 (g)
يكمن مفتاح هذا التفاعل في حالات أكسدة الأكسجين. لاحظ أن الأكسجين موجود في المادة المتفاعلة وأيضًا ناتجي التفاعل. في H2O2 الأكسجين له حالة أكسدة -1. في H2O تكون حالة الأكسدة -2، وقد تم اختزالها. ومع ذلك ، في O2 تكون حالة الأكسدة الخاصة به هي 0 وقد تم تأكسدها. تم تأكسد الأكسجين وتقليله في التفاعل مما يجعل هذا تفاعلًا غير متناسب.
أكتشف المزيد من التجارب مع براكسيلابس !
تطبيقات تفاعلات الأكسدة والاختزال
الأكسدة والاختزال في الكيمياء الكهربية
البطارية عبارة عن جهاز يحول الطاقة الكيميائية إلى طاقة كهربائية باستخدام تفاعلات الأكسدة والاختزال. والآن سنوضح التفاعل بشئ من التفصيل:
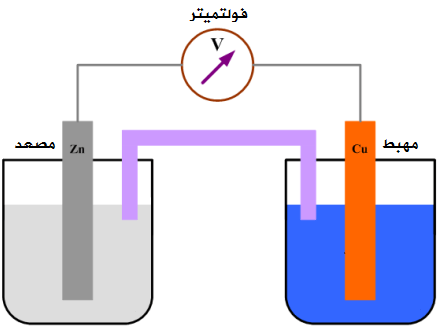
نظام يولد تيارًا كهربائيًا باستخدام التفاعل بين معدن الزنك و أيونات النحاس (II) . في تفاعل الأكسدة والاختزال هذا، ذرات الزنك غير المشحونة تتأكسد إلى أيونات الزنك، ويتم تقليل أيونات النحاس (II) إلى ذرات نحاسية غير مشحونة.
Zn (s) + Cu2 + (aq.) → Zn2 + (aq.) + Cu (s)
الأكسدة:
-Zn (s) → Zn2 (aq.) + 2e
الاختزال:
Cu2 (aq.) + 2e‒ → Cu (s)
يظهر الجزء الأخير كيف يحدث هذا التفاعل عند إضافة معدن الزنك إلى محلول من كبريتات النحاس (II) عندما يصطدم أيون النحاس Cu2 + بمعدن الزنك، يتم نقل 2 إلكترونات من ذرة الزنك مباشرة إلى أيون النحاس(II).
يسمح لنا ترتيب مكونات التفاعل بأن نستخدمه لانتاج الطاقة الكهربية. إعداد الخلية بهذا الشكل يحافظ على نصفي التفاعل منفصلين، مما يتسبب في مرور الإلكترونات المنبعثة في نصف تفاعل الأكسدة من خلال سلك يربط بين نصفي الجهاز. الاسم الصحيح ل إعداد من هذا النوع هو خلية فولتية. بالمعنى الدقيق للكلمة، البطارية عبارة عن سلسلة من الخلايا الفولتية انضموا بطريقة تجعلهم يعملون معًا.
ما هى تطبيقات الأكسدة والاختزال في حياتنا

- يعتمد إنتاج بعض المواد الكيميائية المهمة على التحليل الكهربائي والذي يعتمد بدوره على تفاعلات الأكسدة والاختزال. يتم إنتاج العديد من المواد الكيميائية مثل الصودا الكاوية والكلور وما إلى ذلك باستخدام تفاعلات الأكسدة والاختزال.
- نجد تطبيقًا لتفاعلات الأكسدة والاختزال أيضًا في تعقيم المياه ومواد التبييض.
- يمكن حماية أسطح العديد من المعادن من التآكل من خلال ربطها بأقطاب، والتي تتعرض للتآكل بدلاً من المعادن. من الأمثلة الشائعة على هذه التقنية جلفنة الفولاذ.
- يتضمن الإنتاج الصناعي لمنتجات التنظيف عملية الأكسدة.
- يتم إنتاج حمض النيتريك، وهو أحد مكونات العديد من الأسمدة ، من تفاعل أكسدة الأمونيا.
- الطلاء الكهربائي هوعملية تستخدم فيها تفاعلات الأكسدة والاختزال لتطبيق طبقة رقيقة من مادة على جسم ما. يستخدم الطلاء الكهربائي في إنتاج المجوهرات المطلية بالذهب.
- يتم فصل العديد من المعادن عن خاماتها بمساعدة تفاعلات الأكسدة والاختزال. أحد الأمثلة على ذلك هو صهر الكبريتيدات المعدنية في وجود عوامل الاختزال.
- المصدر الرئيسي للأكسدة هو الأكسجين وبالتالي تفاعل الأكسدة والاختزال أو تفاعلات الأكسدة والاختزال هي المسؤولة عن تلف الطعام.
- الاحتراق هو نوع من تفاعل الأكسدة والاختزال ، وبالتالي فهو تفاعل أكسدة واختزال. الانفجار هو شكل سريع من أشكال الاحتراق ، وبالتالي يمكن التعامل مع الانفجار على أنه تفاعل أكسدة واختزال. حتى مكوك الفضاء يستخدم تفاعلات الأكسدة والاختزال.
الأكسدة والاختزال في علم الأحياء
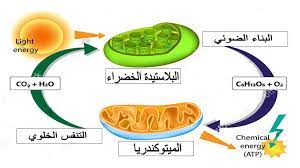
المثال الذي سنناقشه هنا هو التنفس الخلوي والذي يتضمن العديد من التفاعلات التي تنتقل فيها الإلكترونات من جزيء إلى آخر(تفاعلات الأكسدة والاختزال) بهدف الحصول على الطاقة من جزئ الجلوكوز.
C6H12O6 + 6O2 ———— 6 CO2 + 6H2O + Energy
في التنفس الخلوي، تتحرك الإلكترونات من الجلوكوز تدريجيًا عبر سلسلة نقل الإلكترون نحو الأكسجين، وتنتقل إلى حالات طاقة أقل وأقل وتطلق الطاقة في كل خطوة. الهدف من التنفس الخلوي هو التقاط هذه الطاقة في شكل ATP.
الأكسدة والاختزال في العلاج بأشعة الليزر
العلاج بالليزر منخفض المستوى (LLLT) هو نوع من الأدوية التي تستخدم ضوء الليزر في تنشيط الكروموفور (الصبغات الحساسة للجهد) الخلوي وبدء الإشارات الخلوية و الاضطرابات المعدنية الناتجة عن الإشعاع المؤين (IR) المرتبطة بحالة الأكسدة والاختزال في النهاية ستؤدي بدورها إلى تفاعل في الميتوكوندريا لإنتاج المزيد من الطاقة.
جرب الآن براكسيلابس مجانًا
تقدم براكسيلابس محاكاة افتراضية لمعامل الكيمياء .. قم بإنشاء حساب مجاني الآن وجرب المعامل الافتراضية التي يمكنك الوصول إليها في أي وقت وفي أي مكان لإجراء مجموعة متنوعة من التجارب الافتراضية.
 براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس
براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس






