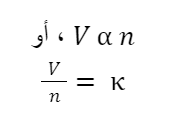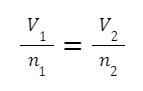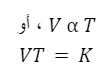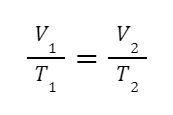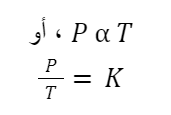تعد الكيمياء فرعًا لا غنى عنه من فروع العلم، يتم من خلاله تحليل واختبار ودراسة التفاعلات وردود الأفعال بين الذرات والإلكترونات والعناصر والجزيئات المختلفة والعديد من الجسيمات الأخرى.
وبصفتها فرعًا حيويًا من فروع العلوم، توجد الكيمياء من حولنا بشكل يومي و نلمس آثارها المباشرة. في حين أن التفاعلات والتفاعلات لا تحدث بشكل عشوائي، بل تخضع جميعها للعديد من قوانين الكيمياء التي تمكن علماؤنا من اكتشافها على مدى سنوات عديدة من الحضارة البشرية.
وسواء كنت طالبًا متخصصًا في العلوم أو لا، فمن المفيد لك أن تعرف أهم القوانين -على الأقل- التي تحكم هذا العلم، وطبيعتها، وربما تتطرق لدراستها أيضًا إذا وجدت الأمر مشوقًا للدرجة!
في هذا المقال، سنغطي 9 قوانين من أهم قوانين الكيمياء، وماذا تناقش، وكيف تفسر، وما هي صيغتها الرياضية، بالإضافة إلى أهم تطبيقاتها في حياتنا اليومية… هيا بنا نبدأ!
أنضم إلى براكسيلابس مجاناً الآن!
قوانين الكيمياء
قوانين الكيمياء كثيرة، وهي عرضة للتغيير والتطور مع كل اكتشاف واستنتاج جديد. تعمل جميع قوانين الكيمياء جنبًا إلى جنب مع أي قانون آخر نعرف أنه يحكم الظواهر والتفاعلات الأخرى، سواء كانت هذه القوانين بيولوجية أو رياضية أو فيزيائية، ويُنظر إليها جميعًا في النهاية على أنها “قوانين الطبيعة”.
في الكيمياء، يوجد ثلاثة قوانين يتم النظر إليهم باعتبارهم “قوانين الكيمياء الأساسية”، ألا وهم:
- قانون حفظ الكتلة.
- قانون النسب الثابتة.
- قانون النسب المتعددة.
خلال دراستك للكيمياء، ربما تكون قد عملت عن كثب مع هذه القوانين، دون أن تعرف بالضرورة تسميتها الحقيقية. هنا، سنناقش كل واحد منهم بمزيد من التفصيل والشرح.
-
قانون حفظ الكتلة
يعود تاريخ هذا القانون إلى اكتشاف أنطوان لوران دي لافوازييه في عام 1789، مشيرًا إلى حقيقة بتنا نعرفها الآن، ألا وهي:
“الكتلة لا تُخلق، ولا تُدمر في التفاعلات الكيميائية.”
بعبارة أخرى، وبالنسبة للأنظمة المغلقة، فإن الكتلة الكلية لكل من المواد المتفاعلة ونواتج التفاعل الكيميائي ستظل كما هي على طول التفاعل، وفي أي لحظة خلاله أيضًا.
تم إثبات صحة هذا الاكتشاف من خلال الحسابات والتجارب، مع الأخذ في الاعتبار أن جميع العناصر الغير مُخلقة -أي المكونة بشكل طبيعي- هي عناصر مستقرة جدًا نظرًا لظروف سطح الأرض، ومن هذا المنطلق بدأ وضع الأسس وتمهيد الطريق للكيمياء الحديثة.

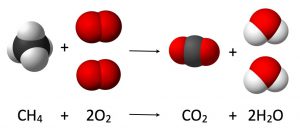
تفاعل احتراق الميثان يوضح قانون حفظ الكتلة -
قانون النسب الثابتة
يُعرف أيضًا باسم “قانون النسب المحددة” أو “قانون بروست”، وقد ذكره الكيميائي الفرنسي لويس بروست لأول مرة في عام 1779، بناءً على عمله على الكبريتيدات والأكاسيد المعدنية والكبريتات. ومع ذلك، فإن الملاحظات الأولى التي تشير إلى وجود هذا القانون قدمها كلًا من الكيميائيين أنطوان لافوازييه وجوزيف بريستلي.
ينص القانون على ما يلي:
“توجد العناصر الفردية التي تشكل مركبًا كيميائيًا معينًا بنسبة ثابتة (من حيث كتلتها)، بغض النظر عن مصدرها.”
لفهم أفضل للقانون، إليك هذا المثال:
يتكون جزيء الماء النقي دائمًا من ذرتين من الهيدروجين وذرة واحدة من الأكسجين، مما يشكل النسبة المعروفة 2:1. أما إذا كنت مغرمًا بالأرقام، فإن غرامًا من الماء النقي يحتوي تقريبًا على 0.11 جرام من الهيدروجين، و 0.88 جرام من الأكسجين.ويعد غاز الميثان مثالًا آخر لمركب كيميائي مشهور يلتزم بهذا القانون، حيث يتطلب الأمر ترابط أربع ذرات من الهيدروجين وذرة واحدة من الكربون ليتكون جزيء ميثان واحد بنجاح.
تستثنى المركبات غير المتكافئة من هذا القانون، حيث تختلف نسبة العناصر فيها من عينة إلى أخرى. كما أن البوليمرات الطبيعية، وعينات العناصر التي تختلف في تركيبها النظيري تعرف جميعها بعدم إتباع هذا القانون والخروج عنه.
ففي جزيء ثاني أكسيد النيتروجين (NO2)، تكون نسبة عدد ذرات النيتروجين والأكسجين 1:2، ونسبة كتلته 14:32 (أو 7:16). ومن ثم، فإنه لا يخضع لقانون النسب الثابتة.أما عن بداية طرحه، فلم يُقابل هذا القانون بأذرع مُرحبة بين الأوساط العلمية، بل لقي معارضة شديدة. ظل الأمر كذلك، ولم يتم قبول هذا القانون إلا بعد أن فضلت نظرية دالتون الذرية استخدام هذا القانون.
كذلك تم إيجاد علاقة رياضية وكيميائية بين القانونين في عام 1811 من قبل الكيميائي السويدي جاكوب برزيليوس. -
قانون النسب المتعددة
كنتيجة لفكرة الجمع بين العناصر لتكوين المركبات التي قدمها لنا قانون النسب المحددة السابق ذكره، بدأت التجارب في تقصي وتوضيح إمكانية دمج أزواج من عناصر معينة معًا لإنشاء أكثر من مركب واحد. نشأ قانون النسب المتعددة من هذا المفهوم، وهو يُعرف أيضًا باسم “قانون دالتون”، وكان قد اقترحَ في عام 1804 من قبل عالم الأرصاد الجوية الإنجليزي جون دالتون. ينص القانون على ما يلي:”عندما تتحد العناصر وتشكل مركبات، يمكن التعبير عن نسب تلك العناصر الأولية من خلال نسب من الأعداد الصحيحة الصغيرة.”
خير مثال على ذلك هو تفاعل الكربون والأكسجين الذي يمكن أن يؤدي إلى تكوين كل من أول أكسيد الكربون (CO)، وثاني أكسيد الكربون (CO2).
في CO، تكون نسبة كمية الأكسجين إلى نسبة الكربون 1:1، بينما في CO2، تكون النسبة 1:2، وكلاهما نسب لأعداد صحيحة بسيطة. يعد هذا القانون أحد أحجار الزاوية في النظرية الذرية الحديثة المعترف بها، جنبًا إلى جنب مع قوانين حفظ الكتلة وقانون النسب المحددة. عززت هذه القوانين مجتمعة افتراض دالتون ومفهومه الذي أقر بأن المادة تتكون من مجموعات مختلفة غير قابلة للتجزئة من بعض اللبنات الأساسية للمادة، ويُقصَد بهذا الذرات.
استند فهمنا الحالي للتركيب والهيكل الذري على هذه القوانين والنظريات، جنبًا إلى جنب مع تضمين بعض المفاهيم الأخرى، مثل: الصيغ الجزيئية، أو الصيغ الكيميائية.
الصيغ الكيميائية
تم احتضان المعرفة الكيميائية للإنسان من خلال قدرته على تكوين وتدشين لغة بسيطة ومشتركة تمكنه من التعبير بسهولة عن تكوين أي مركب، أو جزيء، أو حتى عنصر واحد وتمثيله. تتواصل كل هذه المركبات والذرات معًا للتعبير عن سلسلة من ردود الفعل والتفاعلات عبر استخدام بعض الأحرف والأرقام.
ومن هنا عُرفت هذه اللغة المشتركة باسم الصيغة الكيميائية. يتم تعريف الصيغة الكيميائية على أنها:
“تعبير من الرموز الكيميائية والرموز العددية التي تمثل تكوين وحدة واحدة من المركب.”
احرص على عدم الخلط بين تعريفي كلًا من “الصيغة الكيميائية” مع “الصيغة الهيكلية” واستخدامهما. حيث يكون الأخير عبارة عن تمثيل ورسم ثنائي الأبعاد يوضح العلاقات المكانية للذرات التي تشكل الجزئ أو المركب.
تعتمد الصيغ الكيميائية كليًا على عدد ذرات المركب، ونسبها الموضحة بالأرقام. يمكن أن تكون هذه الصيغ بسيطة، مثل استخدام H (للتعبير عن الهيدروجين)، أو معقدة، كما هو الحال مع CH3CH2OH (بالإشارة إلى الإيثانول).
من الضروري جدًا بالنسبة لك -إذا كنت طالبًا أو عالمًا- أن تعرف وتفهم وتحفظ أكبر عدد ممكن من الصيغ الكيميائية عن ظهر قلب، حيث سيسهل عليك ذلك الكثير من الوقت والمجهود.
أكتشف خطط الإشتراكات المتاحة لدي براكسيلابس
قوانين الكيمياء الثلاثة التي غيرت مفهوم الكيمياء
نظرًا لأن العلم هو الأداة الثورية والمعرفية التي اخترعها الإنسان، فإنه يتطور باستمرار، وقد تحققت – وما تزال – خطواته الفارقة من خلال ربط القوانين والمعلومات ببعضها البعض، ومن ثم محاولة استنتاج قانون جديد، أو صيغة جديدة، أو حتى اختراع جهاز جديد.
في هذه الجزئية، سنشرح ونناقش قوانين الكيمياء الثلاثة التي غيرت مفهوم تجارب الكيمياء فيما يتعلق بالغازات. تتعامل هذه القوانين بشكل أساسي مع درجة الحرارة والضغط والحجم والعديد من الخصائص الأخرى التي تتحكم في كيفية تصرف الذرات والعناصر والمركبات في ظروف مختلفة. القوانين هي:
-
قانون أفوجادرو
إذا كنت قد درست أساسيات الكيمياء فقط، فمن المرجح أنك تعاملت مع قانون أفوجادرو. ينص القانون الشهير على أن:
“الأحجام المتساوية لجميع الغازات، عند نفس درجة الحرارة والضغط، لها نفس عدد الجزيئات.”
تم افتراض هذا القانون التجريبي في عام 1811، وسمي على اسم أميديو أفوجادرو، أستاذ الفيزياء في جامعة تورين. ومع ذلك، فإن القانون لم يُقبل في أوساط المجتمع العلمي إلا بعد عام 1958، عندما تم إنشاء نظام كيميائي منطقي يعتمد بالكامل على هذا القانون، من قبل الكيميائي الإيطالي ستانيسلاو كانيزارو.

العالم أميديو أفوجادرو صاحب قانون أفوجادرو الشهير (المصدر: Britannica) اقترح أميديو أن الغازات المثالية ستحتوي على عدد متساوٍ من الجزيئات، إذا كان لها نفس الحجم، وإذا كانت في نفس ظروف درجة الحرارة والضغط! يُشار علميًا إلى هذا العدد المحدد من الجزيئات برقم أفوجادرو، وهو يساوي 6.02214076 × 1023 جزيء.
يتم تعريف المعادلة الرياضية على النحو التالي:

حيث أن:
V: حجم الغاز،
n: كمية مادة الغاز (تقاس بالمولات)،
K: ثابت التناسب لدرجة حرارة وضغط معينين.مع ثبوت شرطي درجة الحرارة والضغط، يتم التعبير عن العلاقة بين نفس المركبات والمواد على النحو التالي:

تمثل هذه المعادلة تناسبًا طرديًا، كما تحدد أيضًا العلاقة بين عدد مولات الغاز وحجمه.
-
قانون تشارلز
في عمله غير المنشور من ثمانينيات القرن الثامن عشر، صاغ العالم جاك تشارلز هذا القانون، والذي يُعرف أيضًا باسم “قانون الأحجام”.
ينص القانون على ما يلي:
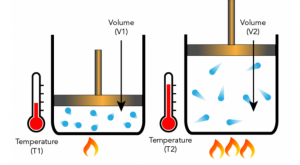
“الحجم الذي تشغله كمية ثابتة من الغاز يتناسب طرديًا مع درجة حرارته المطلقة، إذا ظل الضغط ثابتًا.”
كما أن هذا القانون يصف كيف تفضل الغازات التمدد عند تسخينها.

صورة توضيحية لكيفية عمل قانون تشارلز (المصدر: Let’s Talk Science)
يتم إعطاء المعادلة الرياضية للقانون من خلال:
إذا أردنا المقارنة، يمكننا استخدام الصيغة التالية:

من المعادلات نستنتج أن هناك علاقة عكسية بين درجة الحرارة والحجم.
-
قانون جاي لوساك
صاغ الكيميائي الفرنسي جوزيف جاي لوساك هذا القانون في عام 1808، وهو حجر زاوية آخر في قوانين الغازات. حيث ينص على أن:
“بافتراض ثبات الكتلة والحجم، يتناسب كلًا من ضغط ودرجة حرارة الغاز المثالي بشكل مباشر.”
يمكن كتابة التعبير الرياضي للقانون على النحو التالي:

لاحظ أن T هي درجة الحرارة المطلقة للغاز، وليست أي درجة حرارة عشوائية.
إن تأثير قانون جاي لوساك ملموس في حياتنا اليومية، حيث يمكن أن تختلف الأمثلة من ملاحظة انخفاض ضغط إطارات سيارتك في الشتاء، إلى خزانات البروبان في المنازل، والتي تقرأ ضغطًا أعلى أو أقل تبعًا لدرجة الحرارة المحيطة بها.
الكيمياء، وخاصة الكيمياء العضوية، هي علم دائم التطور، وهو أساس العديد من القوانين والقواعد الأساسية التي توجه وتحكم العديد من الأشياء في حياتنا. إن قوانين الكيمياء الأخرى، مثل: قانون فاراداي، وقانون جراهام، وقانون هس، وقانون لوشاتيليه، وما إلى ذلك، تعد جميعها قوانينًا محورية ومهمة.
تستمر العديد من الأسماء والقوانين في الظهور عندما نغوص في أعماق الكيمياء أكثر وأكثر، وعندما ننتقل من حالة إلى أخرى. المزيد من التجارب الافتراضية المجانية بانتظارك على معامل براكسيلابس – وبالمجان – إذا كنت تود معرفة المزيد عن تجارب الغازات بشكل خاص، أو عن قوانين الكيمياء بشكل عام.
توفر براكسيلابس في المختبر الافتراضي للكيمياء محاكاة لمختلف فروع الكيمياء
 براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس
براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس