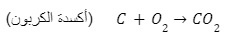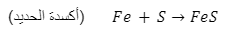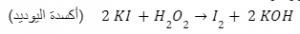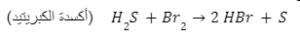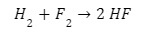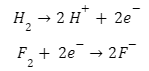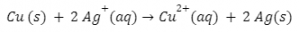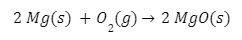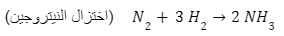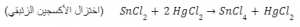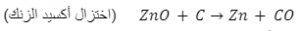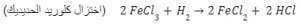الأكسدة والاختزال من أشهر التفاعلات التي تحدث على نطاق واسع في الكيمياء، وفي حياتنا اليومية.
سنتناول معًا في هذا المقال طبيعة الأكسدة والاختزال، وتفاعلاتهما. ، وتعريفهما، والفرق بين جهد الأكسدة وإمكانية الاختزال، والفرق بين عوامل الأكسدة وعوامل الاختزال، بالإضافة إلى ذكر العديد من أمثلة الأكسدة والاختزال لجعل فهمنا أكثر وضوحًا… هيا بنا!
أكتشف خطط الإشتراكات المتاحة لدي براكسيلابس
الأكسدة وتعريفها التاريخي
إذا كنت من محبي المنظفات التي تحتوي على الأكسجين، أو كنت ممتنًا لقوة التعقيم الخاصة بمنتجات بيروكسيد الهيدروجين، فيجب عليك أن تشكر “الأكسدة”. من ناحية أخرى، يمكنك إلقاء اللوم على الأكسدة أيضًا، إذا سبق لك التعامل مع سيارة صدئة أو فاكهة بنية اللون.
الأكسدة هي عملية يمكن أن تبدأ بشكل عفوي أو مصطنع، وهي مفيدة في بعض الأحيان ومدمرة للغاية في حالات أخرى.
المثال الكلاسيكي للغاية للأكسدة هو تفاعل الحديد مع الأكسجين لتكوين أكسيد الحديد، أو تلك المادة الحمراء الشهيرة والتي تميل إلى البرتقالي أحيانًا: الصدأ.

في هذا المثال، يتأكسد الحديد بواسطة الأكسجين ليصبح صدًأ، ويُمكننا تتبع التفاعل الكيميائي عن طريق المعادلة التالية:
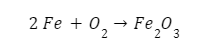
عُرِفت عملية الأكسدة قديمًا على أنها العملية التي تحدث عند إضافة الأكسجين أو أي عنصر كهروسلبي آخر إلى المركب. نشأ هذا الفهم نتيجة لأن الأكسجين (O2) كان أول عامل مؤكسد معروف.
لاحقًا، تم توسيع تعريف الأكسدة ليشمل أنواعًا أخرى من التفاعلات الكيميائية التي لا تحتوي بالضرورة على الأكسجين.
تعريف الأكسدة
في الوقت الحاضر، لا يُنظر إلى مصطلح الأكسدة على أنه متعلق بالأكسجين فقط، ولكن يُنظر إليه على أنه عملية كاملة لا يجب أن تقتصر فقط على وجود الأكسجين. ولكن بدلاً من ذلك، يتم تعريف الأكسدة على أنها:
“فقدان الإلكترونات أثناء تفاعل جزيء، أو ذرة، أو أيون.”
ليست كل العناصر لها نفس الميل لفقد أو اكتساب الإلكترونات. تتأكسد بعض العناصر بسهولة، مثل المعادن، بما في ذلك المغنيسيوم والحديد والصوديوم. في حين أن اللافلزات مثل: الكلور والنيتروجين والأكسجين، لا تتأكسد بسهولة، وهي أكثر ترددًا في فقد إلكتروناتها.
قد تشتمل تفاعلات الأكسدة على عدة أشكال، على النحو التالي:
- إضافة الأكسجين

معادلة توضح أكسدة الكربون - إضافة عنصر كهروسالب

معادلة أكسدة الحديد باستخدام الكبريت - إزالة عنصر كهرو موجب

معادلة توضح أكسدة اليوديد - إزالة الهيدروجين

معادلة توضح أكسدة الكبريتيد
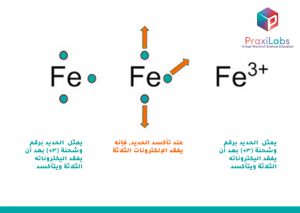
تعريف آخر يهمنا هو تعريف العامل المؤكسد، ألا وهو:
“المادة التي تقبل أو تكتسب أو تستقبل إلكترونًا من عامل مختزل.”
أو باختصار أكثر:
“هو أي مادة تؤكسد مادة أخرى”.
العوامل المؤكسدة في الأمثلة الأربعة المذكورة سابقًا هي: O2, S, Br2, H2O2.
آلية الأكسدة
تحدث عملية الأكسدة على عدة مراحل، وينتج عنها تغيير في خواص الذرة أو المركب الذي يتأكسد. فعلى سبيل المثال، عند تعرض الحديد للأكسدة، يتحول إلى مسحوق هش محمر اللون ويفقد صلابته، بالإضافة إلى أنه يفقد طبيعته الهيكلية القوية. تحدث هذه العملية نتيجة لتعرضه إلى فقدان الإلكترونات.
لنتخيل هذه العملية بشكل أوضح، نلاحظ الرسم البياني التالي الذي يوضح ما يحدث لذرة الحديد عند تأكسدها. يبدأ الحديد في حمل شحنة بمجرد أن يتأكسد. أما عن هذه الشحنة، فهي:
- ليست شحنة واحدة فقط، بل ثلاث،
- وهي شحنات موجبة، حيث تم فقد ثلاث إلكترونات في المقابل.
يُشار إلى هذا كيميائيًا بعلامة (3+) المرفوعة كأس على يمين رمز الحديد (Fe). يتأكسد عنصر الحديد بسهولة، أي أن حماية الحديد من الأكسجين والرطوبة لهو أمر مهم ومفضل دائمًا. وإلى الأبد، سيستمر الحديد في فقد إلكتروناته طالما كان الأكسجين متوفرًا.
أمثلة على تفاعلات الأكسدة
تعتبر العديد من التفاعلات أمثلة رائعة لنذكرها عند ذكر عملية الأكسدة، مثل:
- التفاعل بين الهيدروجين والفلور لإنتاج حمض الهيدروفلوريك، والذي يعطى بواسطة:

معادلة توضح التفاعل بين الهيدروجين والفلور يمكن فهم هذا التفاعل بشكل أفضل إذا قمنا بكتابته مقسمًا إلى جزئين، كالتالي:

نلاحظ أيضًا أن هذا التفاعل لا يحتوي على أي ذرات أكسجين في أي جزء من أجزائه.
- التفاعل بين النحاس والفضة باعتباره مثالاً رائعًا على التفاعلات الكهروكيميائية، ممثلًا كالتالي:

معادلة التفاعل بين النحاس والفضة في هذا التفاعل، يتم وضع سلك من النحاس في محلول أيونات الفضة، فتنتقل الإلكترونات من معدن النحاس إلى أيونات الفضة. ونتيجة لذلك، يتأكسد النحاس عن طريق إطلاق أيوناته في المحلول، وتتراكم الفضة على السلك النحاسي.
- التفاعل بين المغنيسيوم والأكسجين لإنتاج أكسيد المغنيسيوم، هو أحد أمثلة تفاعلات الأكسدة، حيث يكون الأكسجين واضحًا في المعادلة. وهذا يُوضح في المعادلة التالية:

معادلة توضح كيفية تكوين أكسيد المعنيسيوم
تعريف الاختزال
تُعرف العملية المضادة لعملية الأكسدة باسم عملية الاختزال، ومن المنطقي تعريفها على أنها عملية اكتساب الإلكترونات. أما عن تعريف الاختزال، فهو:
“عملية اكتساب الإلكترونات أثناء تفاعل جزيء، أو ذرة، أو أيون.”
أما تاريخيًا، فقد عُرِف الاختزال كما لو كان عملية يتم فيها إضافة الهيدروجين أو أي عنصر كهرو موجب.
آلية الاختزال
لا تختلف آلية الاختزال عن آلية الأكسدة كثيرًا. فهنا، وبدلاً من فقدان الإلكترونات كما هو الحال مع الأكسدة، تكتسب العناصر إلكترونات، ويقال أن المركب أصبح مُختزلًا. كما تحدث العديد من التغييرات في خصائص الذرة أو المركب الذي يتم اختزاله.
أمثلة على تفاعلات الاختزال
تشمل تفاعلات الاختزال عدة أشكال، على النحو التالي:
- إضافة الهيدروجين

معادلة توضح اختزال النيتروجين - إضافة عنصر كهروموجب

معادلة توضح اختزال الأكسجين الزئبقي - إزالة الأكسجين

معادلة توضح اختزال أكسيد الزنك - إزالة عنصر كهروسالب

معادلة توضح اختزال كلوريد الحديديك
وكما قمنا بتعريف عامل الأكسدة، لابد وأن نُعرف عامل الاختزال أيضًا، كالتالي:
“هو مادة تعطي أو تفقد أو تتبرع بإلكترون من عامل مؤكسد.”
أو لنكون أكثر اختصارًا:
“هو أي مادة تقوم بأكسدة مادة أخرى”.
أما عوامل الاختزال في الأمثلة السابقة، فهي: H2, HgCl2, C.
جرب معمل العلوم الافتراضي من براكسيلابس في أفرع الكيمياء المختلفة حيث يوجد أكثر من 45 تجربة مختلفة
أطلب ديمو مجاني الآن! لتعش تجربة المعامل الإفتراضية

أهمية الأكسدة والاختزال
- يعتمد إنتاج بعض المواد الكيميائية المهمة على التحليل الكهربائي الذي يعتمد بدوره على تفاعلات الأكسدة والاختزال. يتم إنتاج العديد من المواد الكيميائية مثل الصودا الكاوية والكلور وما إلى ذلك باستخدام تفاعلات الأكسدة والاختزال.
- تلعب تفاعلات الأكسدة والاختزال دور هاما في تعقيم المياه و في تصنيع مواد التبييض.
- يعتمد الإنتاج الصناعي لمنتجات التنظيف على عملية الأكسدة.
- يتم إنتاج حمض النيتريك ، وهو مكون أساسي للعديد من الأسمدة ، من تفاعل أكسدة الأمونيا.
- الطلاء الكهربائي هو عملية تستخدم تفاعلات الأكسدة والاختزال لتطبيق طبقة رقيقة من مادة على جسم ما. يستخدم الطلاء الكهربائي في إنتاج المجوهرات المطلية بالذهب.
- يتم فصل العديد من المعادن عن خاماتها بمساعدة تفاعلات الأكسدة والاختزال. أحد الأمثلة على ذلك هو صهر الكبريتيدات المعدنية في وجود عامل مختزل.
- الاحتراق هو نوع من تفاعل الأكسدة والاختزال ، وبالتالي فهو تفاعل أكسدة واختزال. الانفجار هو شكل سريع من أشكال الاحتراق ، وبالتالي يمكن التعامل مع الانفجار على أنه تفاعل أكسدة واختزال. حتى مكوك الفضاء يستخدم تفاعلات الأكسدة والاختزال. يؤدي الجمع بين بيركلورات الأمونيوم ومسحوق الألومنيوم داخل معززات الصواريخ إلى تفاعل أكسدة واختزال.
العلاقة بين الأكسدة والاختزال
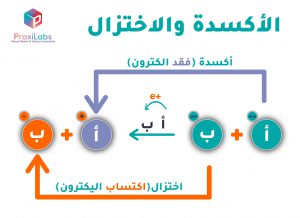
الأكسدة والاختزال هما عمليتان متزامنتان تحدثان معًا، وتؤديان إلى تفاعل مشهور جدًا، يُعرف باسم تفاعل الأكسدة والاختزال (redox reaction). من خلال هذا التفاعل، تكتسب الذرات – أو المركبات – الإلكترونات وتفقدها في نفس الوقت.
مثال على تفاعلات الأكسدة والاختزال
في التفاعل بين الهيدروجين والفلور ، يتأكسد الهيدروجين ويقل الفلور:
H2 + F2 → 2 HF
هذا التفاعل تلقائي ويطلق 542 كيلو جول لكل 2 جم من الهيدروجين لأن رابطة H-F أقوى بكثير من رابطة F-F الضعيفة عالية الطاقة. يمكننا كتابة هذا التفاعل الكلي في صورة نصف تفاعل:
تفاعل الأكسدة:
H2 → 2 H+ + 2 e−
تفاعل الاختزال:
F2 + 2 e− → 2 F−
العناصر حتى في الشكل الجزيئي، لها دائما حالة أكسدة تساوي صفر.
في تفاعل النصف الأول، يتأكسد الهيدروجين من حالة أكسدة من صفر إلى حالة أكسدة +1.
في تفاعل النصف الثاني ، يتم تقليل الفلور من حالة أكسدة من صفر إلى حالة أكسدة -1.
عند جمع التفاعلات معا ، يتم إلغاء الإلكترونات وتتحد الأيونات لتكوين فلوريد الهيدروجين:
2 H+ + 2 F− → 2 HF
ويكون التفاعل النهائي العام هو
H2 + F2 → 2 HF
أشهر الأسئلة حول تفاعلات الأكسدة-الاختزال
ما هي العوامل المؤكسدة والمختزلة؟

العوامل المؤكسدة هي المواد التي تكتسب الإلكترونات ويتم اختزالها في التفاعلات الكيميائية.
العامل المؤكسد يعرف أيضا باسم مستقبل الإلكترون ، وعادة ما يكون العامل المؤكسد في إحدى حالات الأكسدة المحتملة الأعلى لأنه سيكتسب الإلكترونات وينخفض.
تشمل أمثلة العوامل المؤكسدة الهالوجينات ونترات البوتاسيوم وحمض النيتريك.
العوامل المختزلة هي المواد التي تكتسب لإلكترونات وتتأكسد في التفاعلات الكيميائية.
يعرف العامل المختزل باسم المتبرع أو المانح للالكترونات، عادة ما يكون عامل الاختزال في إحدى حالات الأكسدة المنخفضة الممكنة. يتأكسد عامل الاختزال، لأنه يفقد الإلكترونات في تفاعل الأكسدة والاختزال.
تشمل أمثلة عوامل الاختزال المعادن الأرضية وحمض الفورميك ومركبات الكبريتيت.
كيف يمكن تحديد العوامل المؤكسدة والمختزلة؟
العوامل المؤكسدة هي المواد التي تكتسب الإلكترونات ويتم اختزالها في التفاعلات الكيميائية.
العوامل المختزلة هي المواد التي تكتسب لإلكترونات وتتأكسد في التفاعلات الكيميائية.
دعونا نذكر مثال لمزيد من التوضيح:
حدد العوامل المختزلة والمؤكسدة في تفاعل الأكسدة والاختزال التالي:
Cl2(aq)+2Br−(aq)⟶2Cl−(aq)+Br2(aq)
الحل:
في نصف تفاعل الأكسدة
2Br−(aq)⟶Br2(aq)
حالات الأكسدة: -1 0
في نصف تفاعل الاختزال
Cl2(aq)⟶2Cl−(aq)
حالات الأكسدة: 0 -1
بشكل عام
Br- يفقد الكترون. يتأكسد من Br- إلى Br2 ؛ وبالتالي ، فإن Br- هو عامل الاختزال.
Cl2 يكتسب إلكترونا واحدا. يتم اختزاله من Cl2 إلى 2 Cl- ؛ وبالتالي Cl2 هو العامل المؤكسد.
ما هي التفاعلات الكيميائية التي تؤدي إلى الأكسدة والاختزال
من أنواع تفاعلات الأكسدة والاختزال:
- تفاعلات الاتحاد Combination Reactions
- تفاعلات التحلل أوالتفكك Decomposition reaction
- تفاعلات الإزاحة أو الإحلال Displacement Reaction
- تفاعلات عدم تناسب Disproportionation
- تفاعلات الاحتراق Combustion
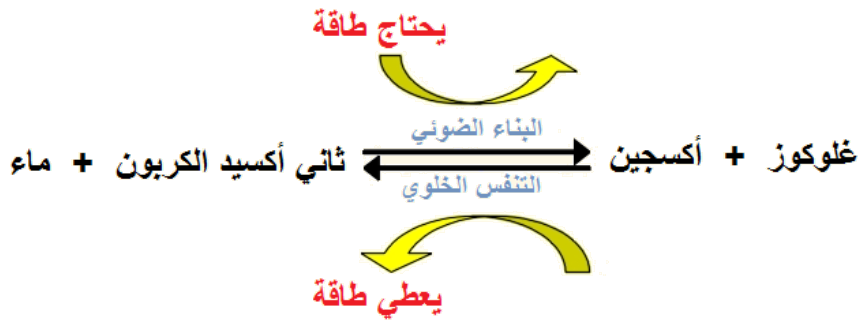
ما هي التفاعلات الكيميائية التي تؤدي إلى الأكسدة والاختزال في الجسم الحي؟
- التنفس الخلوي
التنفس الخلوي هو تفاعل أكسدة واختزال ، أي يحدث كل من الأكسدة والاختزال ) هناك فقدان وكسب للإلكترونات).
حيث تتأكسد جزيئات الجلوكوز ويتم اختزال جزيئات الأكسجين لتوليد جزيئات الماء. لذلك، يطلق عليه تفاعل الأكسدة والاختزال.
بشكل تفصيلي أكثر:
التنفس الخلوي يتضمن العديد من التفاعلات التي تنتقل فيها الإلكترونات من جزيء إلى آخر(تفاعلات الأكسدة والاختزال) بهدف الحصول على الطاقة من جزئ الجلوكوز.
C6H12O6 + 6O2 ———— 6 CO2 + 6H2O + Energy
في التنفس الخلوي، تتحرك الإلكترونات من الجلوكوز تدريجيًا عبر سلسلة نقل الإلكترون نحو الأكسجين، وتنتقل إلى حالات طاقة أقل وأقل وتطلق الطاقة في كل خطوة. الهدف من التنفس الخلوي هو التقاط هذه الطاقة في شكل ATP.
- حرق الكربون في الأكسجين لإنتاج ثاني أكسيد الكربون (CO2)
كيف يؤثر الأكسدة والاختزال على المادة الكيميائية؟
تؤثر الأكسدة والاختزال على المادة الكيميائية من خلال يتضمن نقل الإلكترونات بين نوعين، حيث يحدث تفاعل كيميائي يتغير فيه عدد أكسدة الجزيء أو الذرة أو الأيون عن طريق اكتساب الإلكترون أو فقده.
ويتم إعطاء النوعين اللذين يتبادلان الإلكترونات في تفاعل الأكسدة والاختزال أسماء خاصة. يسمى الأيون أو الجزيء الذي يقبل الإلكترونات العامل المؤكسد. من خلال قبول الإلكترونات ، فإنه يتسبب في أكسدة نوع آخر.
على العكس من ذلك ، فإن الأنواع التي تتبرع بالإلكترونات تسمى عامل الاختزال ؛ عندما يحدث التفاعل ، فإنه يقلل من الأنواع الأخرى. بمعنى آخر، ما يتأكسد هو العامل المختزل وما يتم تقليله هو العامل المؤكسد. (ملاحظة: يمكن أن تكون العوامل المؤكسدة والمختزلة نفس العنصر أو المركب ، كما هو الحال في تفاعلات عدم التناسب).
ما هي تفاعلات الأكسدة – الاختزال في الكيمياء العضوية؟
| تفاعلات الأكسدة | تفاعلات الاختزال |
| الأكسدة هي فقدان الإلكترونات أثناء تفاعل جزيء أو ذرة أو أيون. | الاختزال هو كسب الإلكترونات أثناء تفاعل جزيء أو ذرة أو أيون. |
| الأكسدة هي العملية التي تكتسب من خلالها ذرة الكربون روابط بعناصر أكثر كهربية ، مع كون الأكسجين هو الأكثر شيوعا. | الاختزال هو عملية تكتسب من خلالها ذرة الكربون روابط بعناصر أقل كهربية ، مع كون الهيدروجين هو الأكثر شيوعا. |
| هناك أشكال عديدة من تفاعلات الأكسدة:
إضافة الأكسجين C + O2 → CO2 (أكسدة الكربون) إضافة عنصر كهروسلبي Fe + S → FeS (أكسدة الحديد) إزالة الهيدروجين H2S + Br2 → 2 HBr + S (أكسدة الكبريتيد) |
هناك العديد من أشكال تفاعلات الاختزال:
إضافة الهيدروجين N2 + 3 H2 → 2 NH3اختزال النيتروجين إزالة الأكسجين ZnO + C → Zn + CO (اختزال أكسيد الزنك) إزالة العنصر الكهربي 2 FeCl3 + H2 → 2 FeCl2 + 2 HCl (تقليل كلوريد الحديديك) |
| العامل المؤكسد هو مادة تقبل أو تكتسب أو تستقبل إلكترونا من عامل اختزال. | عامل الاختزال هو مادة تعطي أو تفقدها أو تتبرع بإلكترون من عامل مؤكسد. |
ما هي أمثلة الأكسدة؟
الصدأ هو شكل من أشكال تآكل المعدن. يحدث التآكل بسبب تأثر المعدن بفعل الماء (الرطوبة) والهواء نتيجة لأكسدة المعدن. يلتقط الحديد الصدأ لأنه يتأكسد في وجود الهواء والماء لتكوين أكسيد الحديد المائي (Fe2O3.xH2O).
يشكل أكسيد الحديد غطاء بنيا محمرا على السطح المعدني.
4Fe + 3O2 + 2xH2O – > Fe2O3.xH2O
التنفس هو العملية التي تحدث داخل أجسامنا ، مما يؤدي إلى تفاعل الأكسدة. يتأكسد الطعام خلال دورات التمثيل الغذائي لانتاج الطاقة التي نحتاجها لحياتنا.
يمكن أن يتسبب الأكسجين الموجود في الهواء في تحول شرائح الفاكهة إلى اللون البني ، وهي عملية تسمى الاسمرار الأنزيمي والتي تعتبر تفاعل أكسدة. في خلايا التفاح ، تم العثور على الفينولات وإنزيم الفينولاز ، وعند تعرضها للأكسجين في الهواء، على سبيل المثال من خلال التقطيع ، يتسبب الأكسجين في تفاعل (أكسدة).
 براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس
براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس