لفهم تفاعل ديلز ألدر جيدا ، سنوضح أولا بعض التعريفات المهمة مثل الألكين والداين.
ألكين (Alkene)
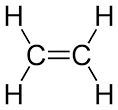
ألكينات Alkenes هي فئة أو مجموعة من الهيدروكربونات التي تحتوي على رابطة ثنائية واحدة من الكربون – الكربون على الأقل.
يُعرف الألكين أيضا باسم الأوليفين وصيغته العامة هي CnH2n. الألكينات أكثر تفاعلا من الألكانات بسبب وجود الرابطة المزدوجة الكربونية التي تجعل الألكينات أكثر تفاعلا من الألكانات (تحتوي على رابطة أحادية الكربون والكربون)
داين (Diene)
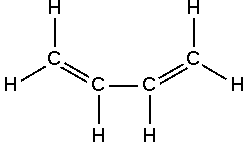
داين Diene هو مركب يحتوي على رابطتين مزدوجتين ، عادة تكون بين ذرات الكربون.
هناك 3 أنواع من الداينات:
- الداينات المتراكمة (Allene): تحتوي هذه الفئة من الداين على 2 روابط مزدوجة متتالية على ذرة الكربون المجاورة.
- الدينات المعزولة غير المقترنة: تحتوي على 2 روابط مزدوجة مفصولة ب اثنين أو أكثر من الروابط المزدوجة.
- الدينات المقترنة: تحتوي على 2 روابط مزدوجة مقترنة أو مفصولة برابطة واحدة. يتم استخدام هذا النون من الدينات على نطاق واسع في صناعة البوليمر.
ملاحظة: يعتمد هذا التصنيف على موضع الرابطة المزدوجة في الجزيء.
في هذه المقالة ، سنوضح تفاعل ديلز الدر ، وآلية عمله ، وأمثلته ، وأشهر تطبيقاته والانتقالية الموضعية في تفاعلات ديلز، والمختبر الافتراضي للتجربة التي توفرها براكسيلابس والمزيد.
في عام 1928 ، اكتشف الكيميائيان الألمانيان أوتو ديلز وكورت ألدر تفاعل ديلز-ألدر ، والذي حصلا بسببه على جائزة نوبل في الكيمياء في عام 1950.
ما هو تفاعل ديلز ألدر؟
في الكيمياء العضوية، يعتبر تفاعل ديلز ألدر أحد أكثر التفاعلات حيوية و أهمية. المواد المتفاعلة لهذا التفاعل هي ألكين بديل المعروف باسم (dienophile)محب الدايين و دايين مترافق. يؤدي تفاعل ديلز ألدر إلى توليف مركبات عضوية دورية حلقية مكونة من ستة عناصر تعرف باسم cyclohexenes سيكلوهكسين.
لذا يمكننا تعريف تفاعل ديلز ألدر ببساطة على أنه التفاعل بين ألكين بديل وداين مقترن لإعطاء سيكلوهكسين.
النمط الأساسي لتفاعل ديلز ألدر
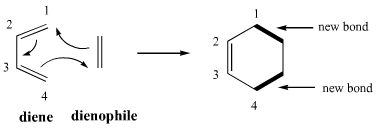
آلية تفاعل ديلز-ألدر داخل الجزيء الواحد
تفاعل ديلز ألدر هو تفاعل (من تفاعلات حول الحلقات) يحدث بين جزيء داين وجزيء دينوفيل.
يتضمن هذا التفاعل عموما تداخلا بين أعلى مدار جزيئي مشغول (HOMO) يحتوي على إلكترونات 4π من جزيء الداين مع أدنى مدار جزيئي غير مشغول يحتوي على إلكترونات 2 π من جزيء الدينوفيل لتشكيل ناتج إضافة سيكلو ، لذلك يعرف هذا التفاعل أيضا باسم تفاعلات إضافة الحلقة [4 + 2] الهدف الاساسي للتفاعل هي تكوين روابط σ جديدة ، والتي تكون أكثر استقرارا بنشاط من الروابط π.
يحدث التفاعل في 2 خطوات:
- يتفاعل الداين مع الألكين الذي يشكل حلقة سيكلوهيكسين جديدة.
- حلقة السيكلوهيكسين الجديدة تعيد ترتيب تشكيل المنتج النهائي.
يوضح الفيديو التالي آلية تفاعل ديلز-ألدر داخل الجزيء الواحد
معادلة تفاعل ديلز ألدر
توضح المعادلة التالية الشكل الأساسي لتفاعل ديلز ألدر
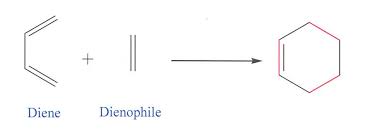
تفاعل ديلز ألدر هو إضافة حلزونية لنظام pi 4 + 2 pi (diene + dienophile) الذي يشكل مادة أكثر استقرارا لأن روابط سيغما التي تم تشكيلها أكثر استقرارا من روابط pi باي التي تم كسرها.
تفاعل ديلز ألدر غير المتجانس
في الكيمياء ، يشير hetero إلى أي ذرة ليست هيدروجين أو كربون.
في تفاعل ديلز-ألدر الغير متجانس ، يحتوي إما الداين أو الألكين (الدينوفيل) على ذرة غير متجانسة، وغالبا ما تكون نيتروجين أو أكسجين. يعتبر تفاعل غير متجانس غير متماثل – ديلز – ألدر لمركبات الكربونيل واحدة من أقوى الطرق لبناء دورات غير متجانسة نشطة بصريا ، وقد استخدم على نطاق واسع في عملية تخليق المركبات الطبيعية والاصطناعية النشطة بيولوجيا.
أنضم إلى براكسيلابس مجاناً الآن!
خصائص تفاعل ديلز ألدر
- يشكل التفاعل حلقة جديدة من ستة أعضاء.
- على الدينوفيل، مجموعات سحب الإلكترون تخفف من التفاعل.
- على الداين ، تخفف مجموعات التبرع بالإلكترون من التفاعل.
- يجب أن يكون مكون الداين قادرا على ترتيب مطابقة s-cis.
- التفاعل نمطي فيما يتعلق بالتكوين البديل في كل من الداين والدينوفيل.
- قد يمنع العائق الستيري في مواقع الترابط رد الفعل. وبسبب العائق الستيري ، فإن تشكيل s-cis أعلى في الطاقة من التشكيل s-trans.
أمثلة على تفاعل ديلز ألدر
- مثال على تفاعل ديلز ألدر هو الإضافة الحلقية للأنثراسين (الدايين المترافق) وأنهيدريد الماليك (dienophile) لتشكيل 9,10-dihydroanthracene-9,10-endo-a3-succinic anhydride.
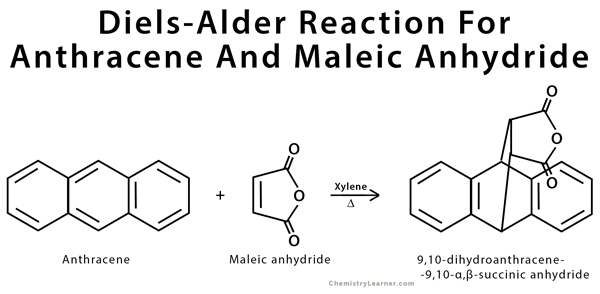
يعرف أنهيدريد ماليك بأنه داينوفيل شديد التفاعل بسبب وجود بديلين للكربونيل يسحبان الإلكترون داخل تركيبته الكيميائية. من ناحية أخرى ، فإن الأنثراسين ليس دايين شديد التفاعل بسبب كل من عائقه الستيري بالإضافة إلى استقراره العالي بسبب العطرية.
- التفاعل بين 1,3‐بوتادين وأنهيدريد ماليك
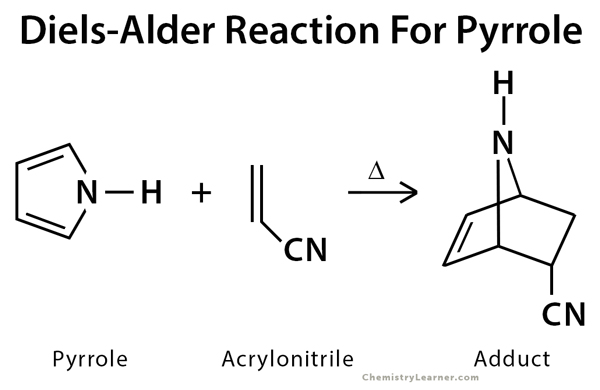
- التفاعل بين بيرول و أكريلونيتريل
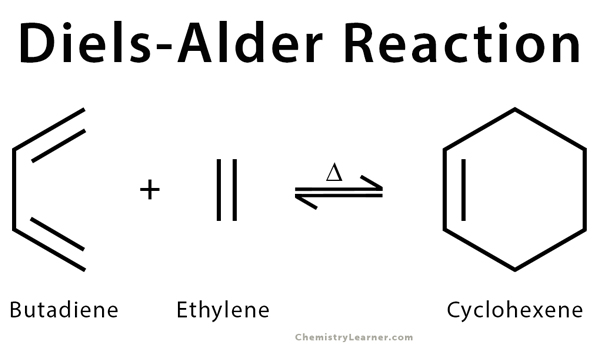
- التفاعل بين البيوتادين والإيثيلين
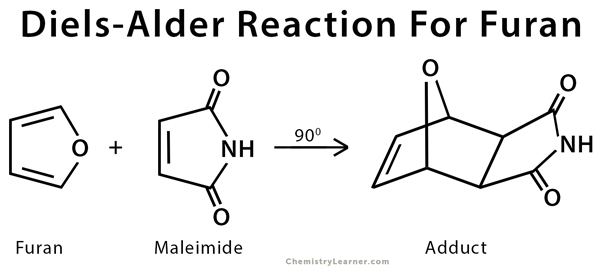
- التفاعل بين الفيوران والمليميد
الكيمياء الفراغية لتفاعل ديلز ألدر
طريقة “المكعب” هي طريقة جيدة لتصور الكيمياء الفراغية للدايين والداينوفيل في تفاعل ديلز ألدر
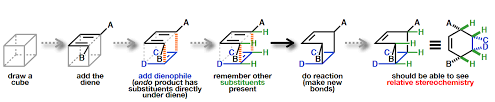
كما هو موضح في الشكل السابق:
- أولا، ارسم مكعبا.
- ثم أضف الداين.
- ثم أضف الدينوفيل.
- ثم تذكر اضافة البدائل الأخرى الموجودة.
- بعد ذلك ، قم بعمل التفاعل وقم بعمل روابط جديدة.
- الآن ، يجب أن تكون قادرا على رؤية الكيمياء الفراغية للتفاعل.
تتفاعل الكيمياء الفراغية للدينوفيل دائما من الوجه الأقل إعاقة ويتم الحفاظ عليها في ناتج تفاعل ديلز ألدر
المجموعات “الخارجية” على الداين اينتهي بها المطاف على نفس وجه الحلقة الجديدة المكونة من ستة أعضاء ، كما تفعل المجموعات “الداخلية”. عندما يتم استبدال كل من الدايين والداينوفيل ، قد تتشكل diastereomers ، والتي نسميها “exo” و “endo” أو قاعدة الناتج اندو.
يشرح الفيديو التالي الكيمياء الفراغية للدايين في تفاعل ديلز ألدر
الانتقائية الموضعية في تفاعلات ديلز – ألدر
تفاعل ديلز ألدرالرجعي هو عكس تفاعل ديلز -ألدر العكسي أو الرجعي هو بالضبط نفس تفاعل ديلز ألدر الرئيسي ، كل ما يحدث حقا هو أنه يتم إنشاء توازن بين دايين وداينوفيل ناتج تفاعل ديلز ألدر.
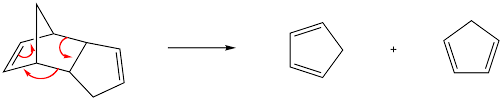
مثال: يتم تقسيم السيكلوهيكسين إلى بوتادين + إيثيلين (عند 800 درجة مئوية).
تطبيقات تفاعل ديلز ألدر
تفاعل ديلز ألدر هو تفاعل مهم جدا في الكيمياء العضوية وله العديد من التطبيقات مثل:
- تخليق المواد الطبيعية مثل المطاط والبلاستيك هو واحد من أهم تطبيقات تفاعل ديلز ألدر.
- في إنتاج فيتامين B6.
- في المستحضرات الصيدلانية وتصنيع مواد مثل الكورتيزون وفيتامين د.
- تحضير الكورتيزون والكوليسترول.
- تتصنيع البروستاجلاندين F2α و E2.
- توليف البولي هيروسيكلات الطبيعية وغير الطبيعية والبولي كربوسايكلز.
- في صناعة البوليمرات وإعداد الهيدروجيل.
- تستخدم أيضا في تكنولوجيا النانو ، على سبيل المثال: في تطوير الطب النانوي الذي يعرض تفضيلا لتفاعلات كيمياء “النقر” الفعالة والسريعة جدا والنظيفة التي تسمح بتوصيل المكونات النشطة وإطلاقها لاحقا عند ارتفاع درجة الحرارة.
- يلعب تفاعل ديلز ألدر دورا ديناميكيا وحيويا في عملية تخليق المواد النانوية مثل الببتيدات اللاصقة للخلايا ، والبوليمرات الكتلية ، وأنظمة توصيل الأدوية.

المعمل الافتراضي لتجربة تفاعل ديلز ألدر من براكسيلابس
توفر براكسيلابس محاكاة مختبرية لتفاعل ديلز ألدر التي يمكنك الوصول إليها في أي وقت وفي أي مكان لتنفيذها.
الهدف العام من تجربة تفاعل ديلز-ألدر هو تخليق ستة مركبات عضوية دورية الأعضاء.
مبدأ تفاعل ديلز ألدر
مثال على تفاعل Diels Alder هو الإضافة الحلقية للأنثراسين (الدايين المترافق) وأنهيدريد الماليك)محب الدايين) لتشكيل 9,10-dihydroanthracene-9,10-endo-a3-succinic anhydride. يستخدم الزيلين كمذيب للتفاعل بسبب غليانه العالي الذي يمكن أن يستوعب درجة الحرارة العالية اللازمة لتشغيل التفاعل الكيميائي.
يعرف أنهيدريد ماليك بأنه ديانوفيل شديد التفاعل بسبب وجود بديلين للكربونيل يسحبان الإلكترون داخل تركيبته الكيميائية. من ناحية أخرى ، فإن أنثراسين ليس دايين شديد التفاعل بسبب كل من عائقه الستيري بالإضافة إلى استقراره العالي بسبب العطرية.
طريقة تفاعل ديلز ألدر
تفاعل كهروحلقي حيث تشارك 4 إلكترونات π من الداين المترافق (أنثراسين) و 2 π إلكترونات من الدينوفيل (أنهيدريد ماليك) في التفاعل في وجود الزيلين كمذيب عند درجة حرارة 350 درجة مئوية. القوة الدافعة هي تشكيل روابط σ جديدة لأنها أكثر استقرارا بنشاط من الروابط π.
بحلول نهاية تجربة تفاعل ديلز-ألدر:
- سوف يصبح الطلاب بارعين في إجراء تفاعلات الكيمياء العضوية.
- سوف يفهم الطلاب آلية ومبدأ وإجراءات تفاعل ديلز ألدر.
- سوف يفهم الطلاب أساسيات إجراءات التوليف والتصنيع العضوي.
- سيتعلم الطلاب وظيفة تفاعل ديلز ألدر ويحصلون أيضا على تدريب على كيفية استخدام الاعادة وإعدادات التفاعل.
توفر براكسيلابس محاكاة المختبر الافتراضي لتفاعل ديلز ألدر الذي يمكنك الوصول إليه في أي وقت لتنفيذ التجربة
أكتشف خطط الإشتراكات المتاحة لدي براكسيلابس
الأسئلة الشائعة
ما هي أهمية تفاعل ديلز ألدر؟
يعد تفاعل ديلز- ألدر حيويا ومفيدا جدا للكيمياء العضوية الاصطناعية حيث أن تفاعلات تشكيل الحلقة مفيدة بشكل عام في الكيمياء العضوية وأيضا بسبب تكوين مركزين نمطيين جديدين في كثير من الحالات. كما أن أهمية تفاعل ديلز ألدر تكمن في استخدامه في العديد من التطبيقات المختلفة في حياتنا كما أوضحنا مسبقا؛ مما يزيد من أهميته.
ما هو ناتج تفاعل ديلز-ألدر؟
ناتج تفاعل ديلز الدر هو عبارة عن مركبات عضوية دورية حلقية مكونة من ستة أعضاء تعرف باسم cyclohexene.
لماذا يعتبر تفاعل ديلز-ألدر تفاعل [4+2]- إضافة حلقية ؟
لأن التفاعل يتضمن على تفاعل الإضافة بين الألكين البديل (الدينوفيل) وجزيء الدايين المترافق من أجل إنشاء نظام سيكلوهكسين بديل.
على وجه التحديد ، يتضمن التفاعل 2 π إلكترونات من الألكين البديل (dienophile) و 4 إلكترونات π من الداين المقترن. لذلك ، يعرف باسم تفاعل كهرودوري تكون قوته الدافعة هي تكوين روابط σ جديدة لأنها أكثر استقرارا بنشاط من الروابط π.
لماذا يعرف تفاعل ديلز-ألدر بأنه تفاعل غير قطبي؟
نظرا لعدم وجود وسيطات مشحونة تتشكل أثناء التفاعل وأيضا لا تشارك أي إلكترونات غير مقترنة في تفاعل الإضافة. يعتبر رد فعل منسق حيث يتم تشكيل العديد من الروابط وكسرها في وقت واحد خلال الحالة الانتقالية.
لماذا تفاعلات ديلز ألدر تعد نمطية؟
لأن البدائل التي تعلقت بالدينوفيل والداين تحتفظ بكيمياءها المجسمة طوال التفاعل.
ملاحظة: يشير النمطي النوعي إلى التفاعل الذي تتحكم فيه الكيمياء المجسمة للمواد المتفاعلة في نواتج التفاعل.
 براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس
براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس






