إذا كنت تدرس الكيمياء، فلا بد أنك تعاملت يومًا مع مادة تتميز بلونها البنفسجي، والتي توجد دائمًا في زجاجة داكنة اللون، ويمكنها أيضًا أن تصبُغ يديك وملابسك .. نعم إنها برمنجنات البوتاسيوم، تُرى ما هي تلك المادة؟ وما خصائصها واستخداماتها؟ وما الهدف من مُعايرتها، وكيف يتم ذلك؟ .. هذا ما سنناقشه في هذا المقال.

نظرة عامة
خصائص برمنجنات البوتاسيوم
الخصائص الفيزيائية:
| الشكل | بلورات بنفسجية داكنة أو سوداء.
لونها بنفسجي ساطع في حالة المحلول. (يمكن أن توجد على شكل أقراص أو مسحوق أو بلورات) |
| الحالة | صلب |
| الرائحة | عديم الرائحة، لكن له طعم حلو. |
| نقطة الغليان | 100 درجة مئوية |
| الكثافة | 2.703 جرام/سم مكعب |
| الذوبانية | – قابل للذوبان في العديد من المركبات العضوية، أيضًا عن طريق الأحماض المركزة مع اطلاق الأكسجين. – قابل للذوبان في الأسيتون، الميثانول، حمض الخليك، أنهيدريد الخليك، البيريدين، بنزونيتريل و السلفولان. |
| الذوبانية في الماء | 6.38 جرام/100 مل (20 °C) |
| نقطة الانصهار | 270 درجة مئوية |
الخواص الكيميائية :
- برمنجانات البوتاسيوم مركب كيميائي غير عضوي، يُعرف أيضًا باسم “بلورات كوندي.”
- عامل مؤكسد قوي وصيغته الكيميائية KMnO4 ويشكل ثاني أكسيد المنجنيز (Mno2) ذو اللون البني الداكن الذي يلطخ أي شيء عضوي.
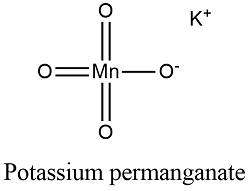
- الوزن الجزيئي / الكتلة المولية لـ برمنجنات البوتاسيوم هو 158.034 جم / مول
- يتم إنتاجه (في الصناعة الكيميائية) من ثاني أكسيد المنجنيز.
- جميع تطبيقات البرمنجنات تقريبًا تستغل خصائصه المؤكسدة.
- يتفاعل بعنف مع حمض الكبريتيك مما يُؤدي إلى حدوث انفجار.
- يتفاعل على الفور مع الجلسرين والكحوليات البسيطة التي تنتج اللهب والدخان.
- يعمل كعامل مؤكسد قوي للغاية في الأوساط الحمضية والمتعادلة والقلوية.
المعادلات التي تمثل الأكسدة في هذه الأوساط هي :-
في الوسط الحمضي:-
2KMnO4 +5Na2SO3+ 3H2SO4 → K2SO4 + 2MnSO4 + 5Na2SO4+3H2O
2 KMnO4 + 16 HCL → 2 MnCL2 + 2 KCL + 8 H2O + 5 Cl2
(حمض الهيدروكلوريك المركز يصنع الكلور)
ملحوظة : تعتمد المواد الناتجة من تفاعلات الأكسدة والاختزال والمحتوية على المنجنيز علي الأس الهيدروجيني (PH). يتم اختزال المحاليل الحمضية للبرمنجنات إلى أيون المنجنيز الوردي الخفيف (Mn2 +)، كما هو الحال في كلوريد المنجنيز (II)
جرب معايره برمنجات البوتاسيوم مجانا
في الوسط المتعادل:-
2KMnO4 +3K2SO3+ H2O → 3K2SO3+2MnO2 + 2KOH
في المحلول المتعادل، يتم اختزال البرمنجنات إلى أكسيد المنجنيز البني (IV) ، حيث يكون المنجنيز في حالة أكسدة +4. أكسيد المنجنيز (IV) هو المادة التي تصبغ الجلد عند وضع برمنجنات البوتاسيوم عليه، وتُختزل تلقائيًا في المحلول القاعدي الى منجنات البوتاسيوم ذات اللون الأخضر، حيث يكون المنجنيز في حالة الأكسدة +6.
في الوسط القلوي:-
2KMnO4+Na2SO3+2KOH → 2K2Mno4+Na2SO4+H2O
يتم اختزال ايون البرمنجنات ( MnO42- ) .
- عند تسخين بلورات البرمنجنات، تتحلل لاطلاق الأكسجين.
2KMno4 → K2Mno4 + Mno2 + O2
- عند تخفيف بلورات البرمنجنات، تتحلل لاطلاق الأكسجين.
2KMno4 + 2H2O Sunlight → 4KOH + 4MnO4+ 3O2
استخدامات برمنجنات البوتاسيوم
- أحد أهم التطبيقات الصناعية للبرمنجنات هو كعامل مؤكسد في التصنيع الكيميائي للعديد من المركبات الهامة.
- يتم استخدامه على نطاق واسع في صناعة معالجة المياه. يتم استخدامه لإزالة الحديد وكبريتيد الهيدروجين (رائحة البيض الفاسد) من مياه الآبار.
- يستخدم كمطهر لتنظيف الجروح وعلاج بعض الأمراض الجلدية مثل الالتهابات الفطرية للقدم والتهاب الجلد.
- تطبيق مهم آخر ، هو في علاج الالتهابات البكتيرية.
- يتم استخدامه في طباعة الأقمشة ودباغة الجلود.
- يتم استخدامه كمادة مُبيضة وكمُبيد للآفات وكمُطهر.
- في تقنية خلايا الوقود ، يستخدم كمستقبل إلكتروني في خلية الوقود الميكروبية.
- في الكيمياء العضوية والتحليلية ، بسبب لونها القوي وطبيعته المؤكسدة ، يتم استخدامها في مختبرات تجارب الكيمياء ككاشف لحساب كمية المادة التي يمكن أن تتأكسد في العينة. ويُشار في التحليل النوعي إلى هذه القيمة باسم “قيمة البرمنجنات”.
تأثير برمنجنات البوتاسيوم على الصحة:-
- في الشكل المركز تعتبرمهيجة للعيون والجلد. يمكن أن تتفاعل مع العديد من عوامل الاختزال أو المواد العضوية ؛لأنها قابلة للاشتعال.
- يعتمد التأثير المضاد للبكتيريا لبرمنجنات البوتاسيوم على عملية أكسدة البروتينات للبكتيريا أو الأنسجة بواسطة هذا المركب.
- يترك بقعة على الجلد أو الأنسجة .
- نظرًا لأنه يعمل من خلال عملية الأكسدة المدمرة لجميع المواد العضوية؛ فإن استخدامه مقيد للأغراض الخارجية فقط.
- يعمل بمثابة ترياق في حالات التسمم بالباربيتورات وهيدرات الكلورال والقلويدات. محلول من 1: 5000 من البرمنجنات عند استخدامه كغسول للمعدة، يؤكسد السم ويمنع امتصاصه.
- عادة ما يتم تخزين هذا المركب في حاويات مغلقة بإحكام. يجب التعامل معه بحذر؛ فقد يحدث انفجار عندما يتلامس مع مواد قابلة للأكسدة بسهولة.
ماذا يحدث إذا تم تناول برمنجنات البوتاسيوم؟
يمكن أن يتسبب تناوله في تلف الجهاز الهضمي العلوي. كما أنه قد يسبب آثارًا سُمية جهازية مثل متلازمة الضائقة التنفسية لدى البالغين، واعتلال التخثر، والفشل الكبدي الكلوي، والتهاب البنكرياس وحتى الموت في الحالات الشديدة.
مخاطر برمنجنات البوتاسيوم
- برمنجنات البوتاسيوم الصلب هو مؤكسد قوي وبشكل عام يجب أن يبقى منفصلاً عن عوامل الاختزال.
- تحتاج بعض التفاعلات إلى القليل من الماء. على سبيل المثال ، سوف يشتعل مسحوق البرمنجنات والسكر البودرة (لكن لا ينفجران) بعد بضع ثوانٍ من إضافة قطرة ماء.
- المحاليل المخففة منه ليست خطيرة. يشكل نواتج خطرة عند مزجه مع الأحماض المركزة.
- يصبغ الجلد والملابس ويجب التعامل معه بحذر. يمكن غسل بقع الملابس باستخدام حمض الأسيتيك. تختفي بقع الجلد خلال 48 ساعة.
تحضير برمنجنات البوتاسيوم
يتم تحضير البرمنجنات تجاريًا عن طريق خلط محلول هيدروكسيد البوتاسيوم (KOH) ومسحوق أكسيد المنغنيز( ( MnO2 مع عوامل مؤكسدة مثل كلورات البوتاسيوم. يغلي الخليط ويَتَبخر ويُسخن المتبقي في أحواض حديدية حتى يكتسب قوامًا كالعجين.
6KOH + 3MnO2 + 6KClO3 → 3K2MnO9 + 6KCl + 3H2O
يتم غلي منجنات البوتاسيوم (الأخضر) في كمية كبيرة من الماء ويتم تمرير تيار الكلور وثاني أكسيد الكربون CO2 والهواء المعالج بالأوزون إلى السائل حتى يتم تحويله إلى برمنجنات. تتم ازالة أكسيد المنجنيز (( MnO2 المتكون باستمرار لمنع تكسير البرمنجنات.
6K2MnO4 + 3Cl2 → 6KMnO4 + 6KCl
يتم استخلاص محلول برمنجنات البوتاسيوم من أي راسب من أكسيد المنجنيز( MnO2 ) المركّز والمُتبلور، ثم يتم عمل طرد مركزي للبلورات وتجفيفها.
معايرة برمنجنات البوتاسيوم –KMno4

ماذا تعني معايرة برمنجنات البوتاسيوم؟ (الهدف)
يعني تحديد قوة البرمنجنات بمحلول معياري من حمض الأكساليك. يساعد هذا التفاعل في دراسة وفهم نظرية الأكسدة والاختزال.
توفر براكسيلابس معامل افتراضية لطلاب والمعلمين والباحثين لإجراء مختلف تجارب الكيمياء
أنضم إلى براكسيلابس مجاناً الآن!
الأدوات والكواشف:
- سحاحة.
- ماء مقطرة.
- ماصة.
- قمع.
- لوح تسخين.
- دورق مخروطي سعة 250 مل.
- دورق سعة 250 مل.
- محلول برمنجنات البوتاسيوم.
- محلول معياري لحمض الأكساليك (0.1 م).
- حمض الكبريتيك.
خطوات العمل :
- نظف السحاحة بالماء المقطر ثم أفرغ الماء ثم اشطف السحاحة بمحلول برمنجنات البوتاسيوم ثم أفرغ السحاحة.
- املأ السحاحة بمحلول برمنجنات البوتاسيوم وسجل نقطة البداية.
- انقل 10 مل من حمض الأكساليك عن طريق الماصة إلى دورق مخروطي نظيف ثم أضف 5 مل من حمض الكبريتيك المخفف ثم سخن المحلول إلى 70 درجة مئوية باستخدام لوح التسخين لتسريع التفاعل بين حمض الأكساليك وبرمنجنات البوتاسيوم.
- ابدأ المعايرة بإضافة محلول البرمنجنات تدريجياً من السحاحة مع هز القارورة باستمرار حتى يتغير اللون من البنفسجي إلى عديم اللون.
- استمر في إضافة محلول البرمنجنات حتى يتغير المحلول من عديم اللون إلى اللون البنفسجي مرة أخرى وخذ نقطة النهاية.
- سجل حجم البرمنجنات البوتاسيوم المستخدم في المعايرة.
- كرر الخطوات السابقة ثلاث مرات ثم احسب متوسط حجم البرمنجنات البوتاسيوم المستخدم في المعايرة ثم احسب تركيز البرمنجنات البوتاسيوم.
بيانات تجريبية:
| التجربة 1 | التجربة 2 | التجربة3 | |
| الحجم الابتدائي لبرمجنات البوتاسيوم | |||
| الحجم النهائي | |||
| الحجم المستخدم | |||
| متوسط الحجم |
المعادلة الكيميائية:
2KMnO4 + 5H2C2O4 + 3H2SO4 → 2MnSO4 + 10CO2 + 18H2O + K2SO4
الحسابات :
a2M1V1 = a1M2V2
حيث :
- M1 (تركيز برمنجنات البوتاسيوم) = ———— مولار
- V1 (متوسط حجم برمنجنات البوتاسيوم) = ———— مل
- M2 (تركيز حمض الأكساليك) = 0.1مولار
- V2 (حجم حمض الأكساليك) = 10مل
- a1 (عدد الإلكترونات المكتسبة لكل وحدة من برمنجنات البوتاسيوم في المعادلة الكيميائية المتوازنة لتفاعل نصف خلية) = 2
- a2 (عدد الإلكترونات المفقودة لكل وحدة حمض الأكساليك في معادلة كيميائية متوازنة لتفاعل نصف خلية) = 5
بالتعويض في المعادلة التالية:
a2M1V1 = a1M2V2
نحصل على M1 = ———–
ثم بالتعويض في المعادلة السابقة يمكنك حساب قوة برمنجنات البوتاسيوم.
المحلول:
- القوة = المولارية * الكتلة الجزيئية
- المولارية = M1 = ———– مولاري
- الوزن الجزيئي لبرمنجنات البوتاسيوم = 158
- لذلك ، القوة = ———- جرام / لتر
تلخيص :
من التجربة المذكورة أعلاه ، يتضح أنه يمكن معايرة برمنجنات البوتاسيوم بشكل فعال باستخدام محلول حمض الأكساليك. بعد إجراء الحساب ، تم تعيين قوة محلول برمنجنات البوتاسيوم المحضر … جرام / لتر
ملاحظات:
- يتغير لون برمنجنات البوتاسيوم مع التفاعل، ولم يتم استخدام أي كاشف آخر في هذه التجربة لتحديد نقطة النهاية حيث أن برمنجنات البوتاسيوم كاشف ذاتي.
- نقوم بتسخين دورق المعايرة المحتوي على حمض الأكساليك إلى حوالي 60-70 درجة مئوية ثم نقوم بمعايرته مقابل برمنجنات البوتاسيوم… إذا كانت درجة الحرارة منخفضة جدًا (أقل من 55 درجة مئوية) ، فإن التفاعل بين حمض الأكساليك وبرمنجنات البوتاسيوم سوف يتحرك ببطء شديد. أما عند درجة حرارة تزيد عن 70 درجة مئوية ، يبدأ حمض الأكساليك في التحلل ، لذلك من المهم البقاء في هذا النطاق (60-70 درجة مئوية).
- يتم التفاعل بين برمنجنات البوتاسيوم وحمض الأكساليك في وسط حمضي لأن أيون البرمنجنات في الوسط الحمضي هو عامل مؤكسد قوي للغاية. يتم إدخال الحموضة عن طريق إضافة محلول مخفف من حمض الكبريتيك.
- في هذه التجربة يعتبر برمنجنات البوتاسيوم هو المحلول المراد معايرته وحمض الأكساليك هو المحلول معلوم التركيز المستخدم في عملية المعايرة. هنا برمنجنات البوتاسيوم هو عامل مؤكسد وحمض الأكساليك هو عامل الاختزال.
- أيون البرمنجنات (MnO4-) له لون بنفسجي غامق. في وسط حمضي – يتحول إلى أيونات المنغنيز عديمة اللون (Mn2 +) عند الوصول إلى نقطة النهاية، فإن إضافة آخر قطرة من البرمنجنات تُعطي لونًا بنفسجيًا فاتحًا الى المحلول.
- يجب التعامل مع الكواشف والأدوات بحذر شديد.
 براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس
براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس






