ما هو ايون الكبريتيت SO₃²⁻ ؟
أيون الكبريتيت هو القاعدة المترافقة لثنائي كبريتيت. وهو أيضًا أحد أكسايد الكبريت، ويعتبر أنيون غير عضوي ثنائي التكافؤ. ويمثل القاعدة المقترنة لكبريتيت الهيدروجين.
على الرغم من أن الكبريتيت ليس متاحًا بشكل شائع، إلا أن أملاحه متوفرة بكثرة بشكل طبيعي في العديد من الأطعمة وتستخدم بشكل شائع كمضافات غذائية. أيون الكبريتيت هو أيون موجود في العديد من الأملاح الثنائية المستخدمة إلى حد كبير في الصناعات الكيميائية.
في هذا المقال سنتعرف على كل ما يخص أيون الكبريتيت كصيغته، رمزه الكيميائي، تركيبه، تكافؤه،تجربة الكشف عنه، أهم تطيقاته، تأثيره على الصحة، وأشهر الأسئلة الشائعة حوله.
ابدا تجربتك الان فى معامل براكسيلابس ثلاثيه الابعاد!
صيغة أيون الكبريتيت
الصيغة الكيميائية لأيون الكبريتيت هي SO₃²⁻
يتكون ايون الكبريتيت من كاتيون كبريت مركز واحد S4+ وثلاثة أنيون أكسجين O2- .
رمز أيون الكبريتيت
يمكن كتابة رمزه الكيميائي على النحو التالي:
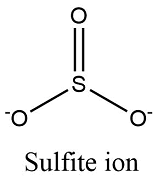
شحنة أيون الكبريتيت
الكبريتيت هو أيون يتكون من ذرة كبريت وثلاث ذرات أكسجين. وشحنته تبلغ (-2).
الشكل الهندسي أو الهيكل
عبارة عن هرم ثلاثي الزوايا مع ذرات الأكسجين الثلاث التي تشكل القاعدة وفوق ذرة الكبريت، يوجد زوج وحيد من الإلكترونات.
تركيب أو هيكل لويس لأيون الكبريتيت
الخطوات التالية مطلوبة لرسم هيكل لويس الخاص ب أيون الكبريتيت:
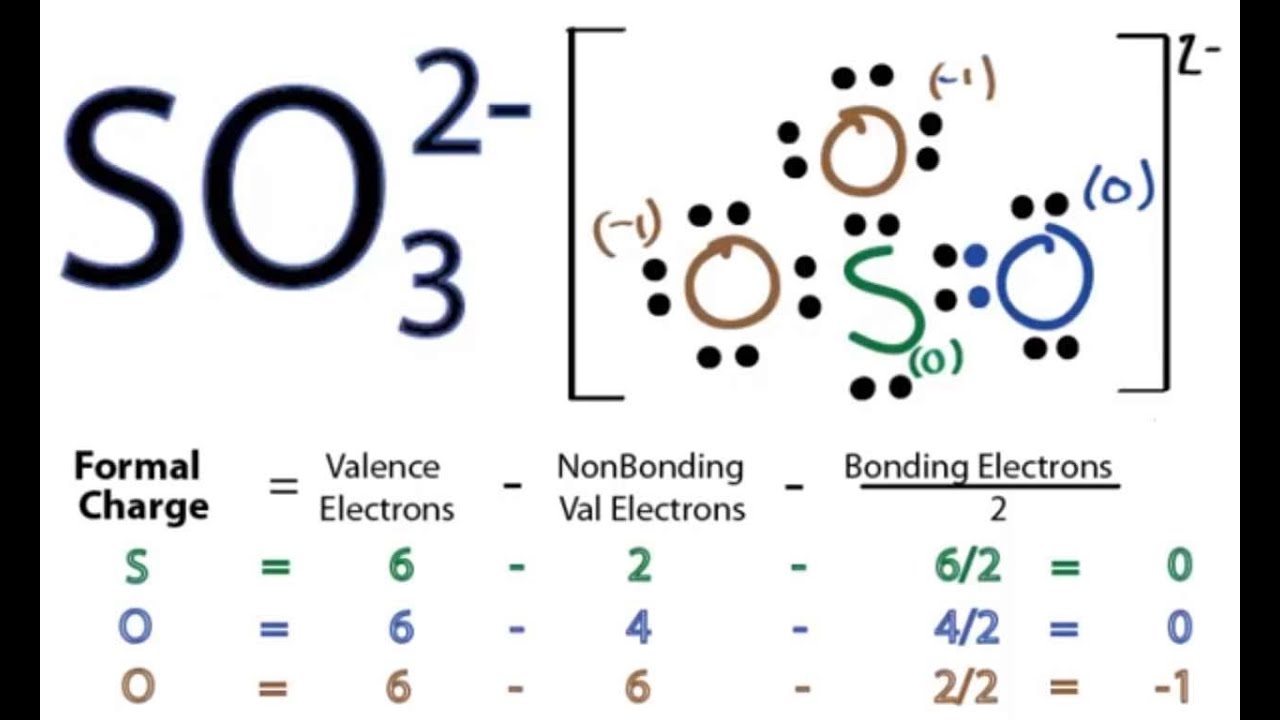
- أولا نوجد العدد الإجمالي لإلكترونات مدارات التكافؤ لذرات الكبريت والأكسجين.
- نحدد مجموع أزواج الإلكترونات.
- نحدد مركز الذرة.
- نضع أزواجًا احادية على الذرات.
- نتحقق من الثبات وتقليل الشحنات على الذرات عن طريق تحويل الأزواج المنفردةأو الاحادية إلى روابط.
فيديو يوضح خطوات رسم هيكل لويس
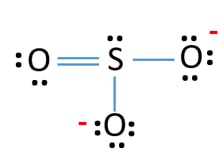
و كما هو موضح بالشكل التالي:
يكون الشكل النهائي لهيكل لويس لأيون الكبريتيت على النحو التالي:
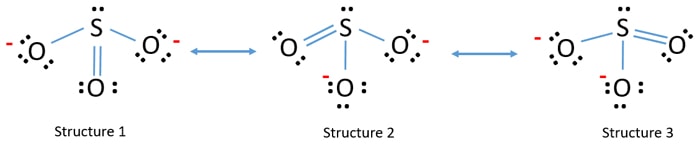
أشكال الرنين لأيون الكبريتيت
يمتلك أنيون الكبريتيت ثلاثة أشكال رنين مكافئة. كل واحد منهم لديه ذرة كبريتية مرتبطة بإحدى ذرات الأكسجين الخاصة به عبر رابطة مزدوجة ويمتلك شحنة رسمية صفرية (محايدة). ترتبط ذرة الكبريت بذرتين من الأكسجين الأخريين من خلال روابط مفردة ، حيث تحمل كل ذرة أكسجين شحنة رسمية مقدارها -1 تشير إلى شحنة ال -2 على أنيون الكبريتيت بأكمله. يوجد زوج وحيد من الإلكترونات غير المرتبط على ذرة الكبريت في الكبريتيت. لذلك، وفقًا لنظرية تدافع الزوج الإلكتروني في مدارات التكافؤ VSEPR، يمتلك أنيون الكبريتيت تكوينًا هرميًا ثلاثي الزوايا مثل الأمونيا (NH3).
و بتغيير موقع الرابطة المزدوجة والأزواج الوحيدة من الجزيء لرسم أشكال رنين لأيون الكبريتيت. يمتلك شكل الرنين الهجين لأنيون الكبريتيت ثلاثة روابط S O مكافئة كما هو موضح أدناه:
الخصائص والتفاعلات الكيميائية لأيون الكبريتيت
الكبريتيت هو أيون مستقر بسبب ثلاث ذرات أكسجين مرتبطة من خلال روابط مزدوجة واثنتين منفردة، لكنها تظل كشكل رنين ترتبط فيه الذرات الثلاث من خلال رابطة لها خصائص الروابط الفردية والمزدوجة. يمكن لهذه البنية أن تثبت الشحنتين السالبتين ، مما يجعل الأيون مستقرًا.
- على الرغم من أن أيون الكبريت يعد قاعدة ضعيفة ، إلا أنه يخضع لتحلل مائي لإنتاج المحاليل الأساسية.
SO32− (aq) + H2O (l) ↔ HSO3− (aq) + OH− (aq)
- في حالة وجود محلول حمضي، يتحول التوازن نحو تكوين حمض الكبريتيت، مما يؤدي إلى تطور غاز ثاني أكسيد الكبريت (SO2) و ثاني أكسيد الكبريت هو غاز عديم اللون له رائحة نفاذة مميزة.
HSO3− (aq.) + 2 H2O (l) ↔ H2SO3 (aq.) + OH− (aq.)
H2SO3 (aq.) ↔ H2O (l) + SO2 (g)
- تتأكسد أيونات الكبريتيت بسهولة عند التعرض للأكسجين في الهواء.
2 SO32− (aq.) + O2 (g) ↔ 2 SO42− (aq)
- لذلك، يمكن أن يزيل ثاني أكسيد الكبريت والكبريتيت لون محلول البرمنجنات. لذلك أيضًا يمكن استخدام التفاعل لاختبار ثاني أكسيد الكبريت.
2MnO4− (aq.) + 5SO2 (g) + 2H2O (l) ↔ 5SO42− (aq.) + 2Mn2 + (aq.) + 4H + (aq.)
- يصنف أيون الكبريتيت كعضو في الشقوق الحمضية للمجموعة الأولى التي يستخدم فيها حمض الهيدروكلوريك ككاشف . يقوم حمض الهيدروكلوريك بإزاحة أيونات الكبريت في أملاحها مما يؤدي إلى تحرير غاز ثاني أكسيد الكبريت SO2 الذي يمكن اكتشافه باستخدام ورق ثنائي كرومات البوتاسيوم.
- يمكن الكشف عن أملاح الكبريتيت القابلة للذوبان مثل كبريتات البوتاسيوم من خلال بعض الاختبارات التأكيدية باستخدام محاليل نترات الفضة أو محاليل أسيتات الرصاص لأنها تتفاعل معًا لتشكل كبريتيت الفضة أو كبريتيت الرصاص على التوالي، على شكل راسب أبيض. يعود هذا إلى الناتج منخفض الذوبان لأملاح الفضة و كبريتيت الرصاص بحيث تترسب بسهولة بالغة عند تركيزات منخفضة جدًا.
- يتم إجراء اختبارات اليود والبرمنجنات كاختبارات محددة للكشف عن أيونات الكبريتيت ، حيث تقوم أيونات الكبريتيت بإزالة لون كلا المحلين بسبب نشاطهما المختزل.
تجربة الكشف عن أيون الكبريتيت من براكسيلابس

الهدف العام لاختبار أيونات الكبريتيت:
الكشف عن وجود أيون الكبريتيت كشق حمضي في الأملاح غير العضوية مثل كبريتيت البوتاسيوم.
أهداف التعلم:
- تحديد وتمييز أيونات الكبريتات واالشقوق الحمضية الأخرى من خلال صيغها الكيميائية.
- تصنيف الأملاح غير العضوية حسب الشقوق الحمضية.
- المقارنة بين الكبريتيت وعناصر المجموعة الأولى الآخرين من حيث التراكيب الكيميائية والخصائص والتفاعلات.
- تحديد جذور الكبريتيت المحتوية على الأملاح تجريبياً.
- تحديدالكواشف المناسبة للكشف عن وجود شق كبريتيت.
- موازنة المعادلات الكيميائية للتفاعلات الكيميائية.
الطريقة:
الكشف عن وجود الكبريتيت كشق حمضي باستخدام كواشف كيميائية محددة.
مبدأ العمل:
في هذه التجربة تم الكشف عن أيون الكبريتيت في كبريتيت البوتاسيوم من خلال بعض الاختبارات التعريفية والتأكيدية. بالإضافة إلى ذلك ، يمكن استخدام هذه الاختبارات للتمييز بين فئة الأنيونية الأولى وفئات الشق الحمضي الأخرى. علاوة على ذلك، يتم استخدام اختبارات تأكيدية ومحددة للتمييز بين تواجد أعضاء مختلفين من الفئة الأولى من الأنيونات.
الخطوات العامة:
أولاً اختبار الذوبان:
في هذا الاختبار يتم اختبار عينة من ملح الكبريتيت للتأكد من قابليته للذوبان في الماء المقطر على البارد.
معظم أملاح الكبريتيت غير قابلة للذوبان في الماء باستثناء الصوديوم والبوتاسيوم وكبريتيت الأمونيوم التي تذوب في الماء دون الحاجة إلى التسخين.
ثانيًا اختبار حمض الهيدروكلوريك:
يعتمد على حقيقة أن حمض الهيدروكلوريك يمكن أن يحل محل أيونات الكبريتيت في ملح البوتاسيوم مكونًا ملح كبريتيت البوتاسيوم وغاز ثاني أكسيد الكبريت. يمكن أن يتفاعل الغاز المتصاعد مع ورق ثنائي كرومات البوتاسيوم مما يتسبب في تغيير لونه إلى اللون الأخضر. خطوتان من ردود الفعل هما:
الخطوة الأولى: تفاعل كبريتات البوتاسيوم مع حمض الهيدروكلوريك:
K2SO3 + 2HCl → 2KCl + H2O + SO2 ↑
الخطوة الثانية: تفاعل غاز ثاني أكسيد الكبريت مع ثنائي كرومات البوتاسيوم:
3SO2 + K2Cr2O7 + H2SO4 → K2SO4 + Cr2 (SO4) 3 + H2O
ثالثًا اختبار نترات الفضة:
يضاف محلول نترات الفضة إلى محلول كبريتيت البوتاسيوم مما يؤدي إلى ترسيب ملح كبريتيت الفضة باعتباره راسبًا أبيض نتيجة لانخفاض قابلية الذوبان في الناتج. رد فعل الاختبار هو:
K2SO3 + 2 AgNO3 → 2 KNO3 + Ag2SO3 ↓
رابعًا اختبار خلات الرصاص:
يضاف محلول أسيتات الرصاص إلى محلول كبريتيت البوتاسيوم مما يؤدي إلى ترسيب كبريتيت الرصاص باعتباره راسبًا أبيض بسبب انخفاض قابلية الذوبان للناتج كما هو موضح في التفاعل الكيميائي التالي:
K2SO3 + Pb (CH3COO) 2 → 2 CH3COOK + PbSO3 ↓
خامساً اختبار اليود:
يعتبر اختبار اليود بمثابة اختبار محدد للكشف عن وجود أيون الكبريتيت كشق حمضي للملح. يعتمد الاختبار على قدرة ملح الكبريتيت على تقليل محلول اليود إلى يوديد الهيدروجين مما يؤدي إلى تغير لونه البني.
K2SO3 + I2 + H2O → K2SO4 + 2HI
سادساً اختبار برمنجنات البوتاسيوم:
يعتبر اختبار برمنجنات البوتاسيوم اختباراً محدداً للكشف عن وجود أيون الكبريتيت كشق حمضي للملح. يعتمد الاختبار على قدرة ملح الكبريتيت على تقليل برمنجنات MnO4 إلى منجنيز Mn2 + مما يؤدي إلى تغير لونه الأرجواني.
5K2SO3 + 2KMnO4 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O
تقدم معامل براكسيلابس تجربة لمحاكاة معامل العلوم الافتراضية للكشف عن ايون الكبريتيت التي يمكنك الوصول إليها في أي وقت وفي أي مكان و تنفيذها بسهولة
ابدا تجاربك مع براكسيلابس الان مجانا!
تطبيقات أيون الكبريتيت (استخدامات أيون الكبريتيت)
يستخدم الكبريتيت في:
– صناعة الورق.
– معالجة المياه كعامل كاسح للأكسجين.
– صناعة الجلود كعامل نازع للكبريت ومزيل للكلور.
– صناعة النسيج كعامل تبييض.
– كبريتيت الصوديوم مكون في العديد من المستحضرات الصيدلانية وهو فعال في الحفاظ على فاعلية واستقرار الأدوية. يضاف إلى عدد من المستحضرات الدوائية كعامل مضاد للأكسدة ومضاد للميكروبات.
– يستخدم الكبريتيت كمادة حافظة للأغذية مثل كبريتيت الكالسيوم وكبريتيت البوتاسيوم وكبريتيت الصوديوم. يتم استخدامها كعامل مجفف أيضًا، خاصةً للفواكه.
– كما تستخدم بعض الكبريتيتات لإنتاج ملون الطعام بالكراميل.
– توجد الكبريتيتات بشكل طبيعي في جميع أنواع النبيذ إلى حد ما.يتم إدخالها بشكل شائع لإيقاف التخمير في الوقت المطلوب، ويمكن أيضًا إضافتها إلى النبيذ كمواد حافظة لمنع التلف والأكسدة في عدة مراحل من صناعة النبيذ. ثاني أكسيد الكبريت (SO2) يحمي النبيذ ليس فقط من الأكسدة ، ولكن أيضًا من البكتيريا.
الآثار الصحية لأيون الكبريتيت
أيونات الكبريتيت غير قابلة للاشتعال، وبشكل عام، فإن الاستهلاك المعتدل لهذه الأملاح لا يشكل خطورة على الصحة ، على الرغم من أنه يمكن الإبلاغ عنها باعتبارها واحدة من أكثر المواد الحافظة المسببة للحساسية.
تم الإبلاغ عن أن التعرض الموضعي أو الفموي أو بالحقن للكبريتيت يحدث مجموعة من الآثار السريرية الضارة لدى الأفراد الحساسين، بدءًا من التهاب الجلد والاحمرار وانخفاض ضغط الدم وآلام البطن والإسهال إلى تفاعلات الحساسية والربو التي تهدد الحياة.
ينشأ التعرض للكبريتيت بشكل رئيسي من استهلاك الأطعمة والمشروبات التي تحتوي على هذه المواد المضافة ؛ ومع ذلك ، قد يحدث التعرض أيضًا من خلال استخدام المنتجات الصيدلانية ، وكذلك في الأماكن المهنية.
يمكن أن يحدث ارتفاع نسبة الكبريتيت في دم وبول الأطفال بسبب مرض نقص العامل المساعد في الموليبدينوم مما يؤدي إلى تلف الجهاز العصبي والموت المبكر ما لم يتم علاجه.
الفرق بين الكبريتات و الكبريتيت
كل من الكبريتات والكبريتيت مركبات أساسها الكبريت.
الفرق االاساسي بين الكبريتات والكبريتيت هو أن الكبريتات تتكون من أربع ذرات أكسجين مرتبطة بذرة كبريتية بينما يتكون الكبريتيت من ثلاث ذرات أكسجين مرتبطة بذرة كبريتية.
الجدول التالي يوضح ابرز الفروق بين الكبريتات والكبريتيت:
| الكبريتات | الكبريتيت |
| الكبريتات عبارة عن أنيون يتكون من ذرة كبريت مرتبطة بأربع ذرات أكسجين حوله. | الكبريتيت عبارة عن أنيون يتكون من ذرة كبريت مرتبطة بثلاث ذرات أكسجين حوله. |
| الكتلة المولية للكبريتات حوالي 96 جم / مول. | الكتلة المولية للكبريتيت حوالي 80 جم / مول. |
| معظم الكبريتات قابلة للذوبان في الماء. | معظم الكبريتيت غير قابلة للذوبان في الماء. |
| الشكل الهندسي حول ذرة الكبريت هي رباعي السطوح في الكبريتات. | الشكل الهندسي حول ذرة الكبريت هي هرمية مثلثية في الكبريتيت. |
| حالة أكسدة الكبريت في الكبريتات هي +6. | حالة أكسدة الكبريت في الكبريتيت هي +4. |
| لا يمكن للكبريتات الخضوع لتفاعلات الأكسدة. | الكبريتيت يمكن أن يخضع لتفاعلات الأكسدة. |
| الصيغة الكيميائية للكبريتات هو SO₄²- | الصيغة الكيميائية للكبريتيت هي SO32– |
الكبريتات هي أملاح حامض الكبريتيك ، وربما تصادفها بشكل يومي. كبريتات لوريل الصوديوم ، منظف قوي يساعد في إزالة الشحوم عن طريق ربط الزيت بالماء ، وهو موجود في كل شيء من صابون الأطباق ومنظفات الأرضيات إلى غسول الجسم والشامبو ؛ يشعر بعض الأشخاص أن منتجات الجسم قاسية جدًا ، ولهذا السبب يتم الإعلان عن بعض أنواع الشامبو وغيرها من المنتجات على أنها “خالية من الكبريتات”.
أشهر الأسئلة الشائعة حول أيون الكبريتيت
ما نوع الروابط الموجودة فى أيون الكبريتيت؟
روابط ايونية، أيون الكبريتيت هو أيون متعدد الذرات يتكون من ذرتين أو أكثر مرتبطة بروابط تساهمية ، ولكن لا يزال لديها نقص أو فائض من الإلكترونات ، مما ينتج عنه شحنة إجمالية على المجموعة.
ما عدد الكترونات أيون الكبريتيت؟
العدد الإجمالي لإلكترونات التكافؤ لأيون الكبريتيت هو 6 + 3 (6) + 2 = 26.
ما هي شحنة ايون الكبريتيت بالكولوم؟
بما أن ? = ?, ? × ?? –??
اذن
? = −?? = −? × ?, ? × ?? −?? = −?, ? × ?? −?? ?
ما هو تكافؤ الكبريتيت؟
ثنائي التكافؤ.
هل أيون الكبريتيت قطبي أم غير قطبي؟
أيون الكبريتيت قطبي.
ملحوظة: في الكيمياء، القطبية هي فصل شحنة كهربائية تؤدي إلى جزيء أو مجموعات كيميائية لها عزم ثنائي القطب أو متعدد الأقطاب.
يجب أن تحتوي الجزيئات القطبية على روابط قطبية بسبب اختلاف في الكهربية بين الذرات المترابطة. يجب أن يكون للجزيء القطبي الذي يحتوي على اثنين أو أكثر من الروابط القطبية شكل هندسي غير متماثل حتى لا تلغي ثنائيات أقطاب الرابطة بعضها البعض.
يحتوي أيون الكبريتيت على عزم ثنائي القطب متجه وهناك أيضًا اختلاف في الكهربية بين ذرة الكبريت والأكسجين لذلك فهو قطبي.
هل أيون الكبريتيت حمض أم قاعدة؟
أيون الكبريتيت هو قاعدة ضعيفة، لكنه يخضع لبعض التحلل المائي لإنتاج المحاليل الأساسية. في المحلول الحمضي، يتم تحويل التوازن لتشكيل حمض الكبريت، مما يؤدي إلى تطور غاز ثاني أكسيد الكبريت. وهو غاز عديم اللون و له رائحة خانقة مميزة.
هل أيون الكبريتيت يذوب في محلول مائي؟
كبريتيت الصوديوم والبوتاسيوم والامونيا Na + و K + و NH + 4 قابلة للذوبان في الماء. معظم الكبريتيتات الأخرى غير قابلة للذوبان في الماء. ومع ذلك ، نظرًا للطبيعة الأساسية للكبريتيت SO32− ، تذوب جميع الكبريتيتات في محلول حمضي.
براكسيلابس منصة تعليمية توفر معامل افتراضية تفاعلية للطلاب في أي وقت وفي أي مكان، بتكلفة بسيطة وأمان تام .. أنشئ حسابك الآن واكتشف عالم افتراضي للعلوم بين يديك!
 براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس
براكسيلابس المدونة العربية لمعامل العلوم الإفتراضية براكسيلابس

